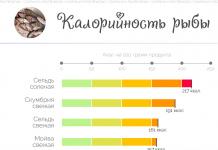
У VIа-групу періодичної системи елементів Д.І. Менделєєва входять кисень, сірка, селен, телур, полоній. Перші чотири з них мають неметаллический характер. Загальна назва елементів цієї групи халькогена,що в перекладі з грец. означає «утворюють руди», вказуючи на їх знаходження в природі.
Електронна формула валентної оболонки атомів елементів VIа-групи.
Атоми цих елементів мають по 6 валентних електронів на s- і р-орбіталях зовнішнього енергетичного рівня. З них дві р-орбіталі заповнені наполовину.
Атом кисню відрізняється від атомів інших халькогенов відсутністю низьколежачих d-підрівні. Тому кисень, як правило, здатний утворювати лише дві зв'язку з атомами інших елементів. Однак в деяких випадках наявність неподіленого пар електронів на зовнішньому енергетичному рівні дозволяє атому кисню утворювати додаткові зв'язку за донорно-акцепторного механізму.
У атомів інших халькогенов при надходженні енергії ззовні число неспарених електронів може збільшуватися в результаті переходу s- і р-електронів на d-підрівень. Тому атоми сірки та інших халькогенов здатні утворювати не тільки 2, але також і 4, і 6 зв'язків з атомами інших елементів. Наприклад, у атома сірки в збудженому стані електрони зовнішнього енергетичного рівня можуть набувати електронну конфігурацію 3s 2 3р 3 3d 1 і 3s 1 3р 3 3d 2:
Залежно від стану електронної оболонки виявляються різні ступені окислення (СО). У з'єднаннях з металами і воднем елементи цієї групи виявляють СО = -2. У з'єднаннях ж з киснем і неметалами сірка, селен і телур можуть мати СО = +4 і СО = +6. У деяких з'єднаннях вони проявляють СО = +2.
Кисень поступається по електронегативності тільки фтору. У фтороксіде F 2 Про ступінь окислення кисню позитивна і дорівнює +2. З іншими елементами кисень проявляє зазвичай в з'єднаннях ступінь окислення -2, за винятком пероксиду водню Н 2 О 2 і його похідних, в яких кисень має ступінь окислення -1. В живих організмах кисень, сірка і селен входять до складу біомолекул в ступені окислення -2.
В ряду О - S - Sе-Ті - Ро збільшуються радіуси атомів і іонів. Відповідно в цьому ж напрямку закономірно знижується енергія іонізації і відносна електронегативність.
Зі збільшенням порядкового номера елементів VIа-групи окислювальна активність нейтральних атомів знижується і збільшується відновна активність негативних іонів. Все це призводить до ослаблення неметалічних властивостей халькогенов при переході від кисню до телуру.
Зі збільшенням порядкового номера халькогенов зростають характерні координаційні числа. Це пов'язано з тим, що при переході від р-елементів четвертого періоду до р-елементів п'ятого та шостого періодів в освіті σ- і π-зв'язків все більшу роль починають грати d - і навіть f-орбіталі. Так, якщо для сірки і селену найбільш характерні координаційні числа 3 і 4, то для телуру - 6 і навіть 8.
У нормальних умовах водневі сполуки H 2 Е елементів VIа-групи, за винятком води, - гази з дуже неприємним запахом. Термодинамічна стабільність цих сполук зменшується від води до водородтеллуріду Н 2 Те. У водних розчинах вони проявляють слабокислотні властивості. В ряду H 2 О-H 2 S-H 2 Sе- H 2 Ті сила кислот зростає.
Це пояснюється збільшенням радіусів іонів Е 2 і відповідним ослабленням зв'язків Е-Н. У тому ж напрямку зростає відновна здатність H 2 Е.
Сірка, селен, телур утворюють два ряди кислотних оксидів: ЕO 2 та ЕО 3. Їм відповідають кислотні гідроксиди складу H 2 ЕО 3 і H 2 ЕО 4. Кислоти H 2 ЕО 3 у вільному стані нестійкі. Солі цих кислот і самі кислоти проявляють окисно-відновну двоїстість, так як елементи S, Sе і Ті мають в цих з'єднаннях проміжну ступінь окислення +4.
Кислоти складу Н 2 ЕО 4 стійкіші і в реакціях поводяться як окислювачі (вищий ступінь окислення елемента +6).
Хімічні властивості сполук кисню.Кисень - найпоширеніший елемент у земній корі (49,4%). Високий вміст і велика хімічна активність кисню визначають переважну форму існування більшості елементів Землі у вигляді кисневмісних сполук. Кисень входить до складу всіх життєво важливих органічних речовин - білків, жирів, вуглеводів.
Без кисню неможливі численні надзвичайно важливі життєві процеси, наприклад дихання, окислення амінокислот, жирів, вуглеводів. Лише поодинокі рослини, звані анаеробними, можуть обходитися без кисню.
У вищих тварин (рис. 8.7) кисень проникає в кров, з'єднується з гемоглобіном, утворюючи легко дисоціюють з'єднання оксигемоглобін. З потоком крові ця сполука надходить в капіляри різних органів. Тут кисень відщеплюється від гемоглобіну і через стінки капілярів дифундує в тканини. Зв'язок між гемоглобіном і киснем нетривка і здійснюється за рахунок донорно-акцепторної взаємодії з іоном Fе 2+.
У стані спокою людина вдихає приблизно 0,5 3 повітря на годину. Але лише 1/5 ч. Вдихається з повітрям кисню утримується в організмі. Однак надлишок кисню (4/5) необхідний для створення високої його концентрації в крові. Це відповідно до закону Фіка забезпечує достатню швидкість дифузії кисню через стінки капілярів. Таким чином, за добу людина фактично використовує близько 0,1 м 3 кисню.
У тканинах кисень витрачається. на окислення різних речовин. Ці реакції в кінцевому рахунку призводять до утворення вуглецю діоксиду, води і створення запасу енергії.
Кисень витрачається не тільки в процесі дихання, а й в процесі гниття рослинних і тваринних решток. В результаті процесу гниття складних органічних речовин утворюються їхні продукти окислення: СО 2, Н 2 О та ін. Регенерація кисню відбувається в рослинах.
Таким чином, в результаті кругообігу кисню в природі підтримується його постійний зміст в атмосфері. Природно, що круговорот кисню в природі тісно пов'язаний з кругообігом вуглецю (рис. 8.8).
Елемент кисень існує у вигляді двох простих речовин (аллотропние модифікації): дікіслорода(Кисню) О2 і трікіслорода(Озону) О 3. В атмосфері практично весь кисень міститься в вигляді кисню О2, зміст же озону дуже мало. Максимальна об'ємна частка озону на висоті 22км становить всього лише 10 -6%.
Молекула кисню О2 під час відсутності інших речовин дуже стабільна. Наявність в молекулі двох неспарених електронів обумовлює її високу реакційну здатність. Кисень - один з найактивніших неметалів. З більшістю простих речовин він реагує безпосередньо, утворюючи оксиди Е x O y Ступінь окислювання кисню в них дорівнює -2. Відповідно до зміни структури електронних оболонок атомів характер хімічного зв'язку, а отже, структура і властивості оксидів в періодах і групах системи елементів змінюються закономірно. Так, в ряду оксидів елементів другого періоду Li 2 О-ВЕО-B 2 O 3-СО 2 -N 2 O 5 полярність хімічної зв'язку Е-Овід I до V групі поступово зменшується. Відповідно до цього послаблюються основні і посилюються кислотні властивості: Li 2 О - типовий основний оксид, ВеО - амфотерний, а B 2 O 3, СО 2 і N 2 O 5 - кислотні оксиди. Аналогічно змінюються кислотно-основні властивості і в інших періодах.
У головних підгрупах (А-групах) з збільшенням порядкового номера елемента ионности зв'язку Е-О в оксидах зазвичай збільшується.
Відповідно основні властивості оксидів в групі Li-Nа-К-Rb-Сs та інших А-групах зростають.
Властивості оксидів, обумовлені зміною характеру хімічного зв'язку, являють собою періодичну функцію заряду ядра атома елемента. Про це свідчить, наприклад, зміна за періодами і групам температур плавлення, ентальпій утворення оксидів в залежності від заряду ядра.
Полярність зв'язку Е-ОН в гідроксид Е (ОН) n, а отже, і властивості гідроксидів закономірно змінюються по групах і періодах системи елементів.
Наприклад, в IА-, IIА- і IIIА-групах зверху вниз зі збільшенням радіусів іонів полярність зв'язку Е-ОН зростає. В результаті у воді легше йде іонізація Е-ОН → Е + + ОН -. Відповідно посилюються основні властивості гідроксидів. Так, в групі IА основні властивості гідроксидів лужних металів посилюються в ряду Li-Nа-К-Rb-Сs.
У періодах зліва направо зі зменшенням іонних радіусіві збільшенням заряду іона полярність зв'язку Е-ОН зменшується. В результаті у воді легше йде іонізація Еон ⇄ ЕО - + Н +. Відповідно в цьому напрямку посилюються кислотні властивості. Так, в п'ятому періоді гідроксиди RbОН і Sr (ВІН) 2 є підставами, In (ОН) 3 і Sn (ОН) 4 - амфотерними сполуками, а Н і Н 6 Тео 6 - кислотами.
Найбільш поширений на землі оксид - водень оксид або вода. Досить сказати, що вона становить 50-99% маси будь-якого живої істоти. В організмі людини міститься 70-80% води. За 70 років життя людина випиває близько 25 000 кг води.
Завдяки своїй структурі вода володіє унікальними властивостями. В живому організмі вона є розчинником органічних і неорганічних сполук, бере участь в процесах іонізації молекул розчинених речовин. Вода є не тільки середовищем, в якій протікають біохімічні реакції, а й сама бере активну участь в гидролитических процесах.
Життєво важлива здатність кисню до утворення оксігенільнихкомплексів з різними речовинами. Раніше розглянуті приклади оксігенільних комплексів О2 з іонами металів - переносників кисню в живих організмах - оксигемоглобін і оксігемоціанін:
НbFе 2 + + О 2 → НbFе 2+ ∙ О 2
НсСu 2+ + О 2 → НсСu 2+ ∙ О 2
де Нb - гемоглобін, Нc - гемоцианин.
Маючи дві неподіленого пари електронів, кисень виступає в якості донора в цих координаційних сполуках з іонами металів. В інших з'єднаннях кисень утворює різні водневі зв'язку.
В даний час велика увага приділяється отриманню оксігенільних комплексів перехідних металів, які могли б виконувати функції, подібні до функцій відповідних біонеорганічної комплексних сполук. Склад внутрішньої координаційної сфери цих комплексів аналогічний природним активним центрам. Зокрема, перспективними по здатності оборотно приєднувати і віддавати елементний кисень є комплекси кобальту з амінокислотами і деякими іншими лігандами. Ці сполуки до певної міри можна розглядати як замінники гемоглобіну.
Однією з аллотропних модифікацій кисню є озон О 3. За своїми властивостями озон сильно відрізняється від кисню О2 - має більш високі температури плавлення і кипіння, володіє різким запахом (звідси його назва).
Утворення озону з кисню супроводжується поглинанням енергії:
3О 2 ⇄2О 3,
Озон отримують при дії електричного розряду в кисні. Утворюється озон з О2 і під дією ультрафіолетового випромінювання. Тому при роботі бактерицидних і фізіотерапевтичних ультрафіолетових ламп відчувається запах озону.
Озон - найсильніший окислювач. Окисляє метали, бурхливо реагує з органічними речовинами, при низькій температурі окисляє сполуки, з якими кисень не реагує:
О 3 + 2Аg = Аg 2 О + О 2
РbS + 4О 3 = РbSО 4 + 4O 2
Широко відома якісна реакція:
2КI + О 3 + Н 2 О = I 2 + 2КОН + О2
Окислювальне дію озону на органічні речовини пов'язано з утворенням радикалів:
RН + О 3 → RО 2 ∙ + ОН ∙
Радикали ініціюють радикально-ланцюгові реакції з біоорганічними молекулами - ліпідами, білками, ДНК. Такі реакції призводять до пошкодження та загибелі клітин. Зокрема, озон вбиває мікроорганізми, що містяться в повітрі і воді. На цьому грунтується застосування озону для стерилізації питної води і води плавальних басейнів.
Хімічні властивості сполук сірки.За своїми властивостями сірка близька до кисню. Але на відміну від нього вона проявляє в з'єднаннях не тільки ступінь окислення -2, а й позитивні ступені окислення +2, +4 і +6. Для сірки, як і для кисню, характерна аллотропия - існування декількох елементних речовин - ромбічної, моноклінної, пластичної сірки. У результаті меншою електронегативності порівняно з киснем здатність до утворення водневих зв'язків у сірки виражена слабше. Для сірки характерно освіту стійких полімерних гомоцепей, що мають зигзагоподібну форму.
Освіта гомоцепей з атомів сірки характерно і для її сполук, що виконують істотну біологічну роль в процесах життєдіяльності. Так, в молекулах амінокислоти - цистину є дисульфідних місток -S-S-:
Ця амінокислота грає важливу роль у формуванні білків і пептидів. завдяки дисульфідній зв'язку S-Sполіпептидні ланцюга виявляються скріпленими між собою (дисульфідних місток).
Характерно для сірки і освіту водородсульфідной (сульфгідрильної) тіоловою групи -SН, яка присутня в на амінокислоту цистеїн, білках, ферментах.
Дуже важливою в біологічному відношенні є амінокислота метіонін.
Донором метильних груп в живих організмах служить S-аденозилметионин Ad-S-СН 3 - активована форма метіоніну, в якій метильная група з'єднана через S з аденін Аd. Метильная група метіоніну в процесах біосинтезу переноситься на різні акцептори метильних груп RН:
Ad-S-СН 3 + RН → Ad-SН + R-СН 3
Сірка досить широко поширена на Землі (0,03%). У природі присутня у вигляді сульфідних (ZnS, НgS, РbS і ін.) І сульфатних (Nа 2 SО 4 ∙ 10Н 2 О, СаSО 4 ∙ 2Н 2 О і ін.) Мінералів, а також в самородному стані. Порошок «сірки обложеної» застосовують зовнішньо у вигляді мазей (5-10-20%) і присипок при лікуванні шкірних захворювань(Себореї, псоріазу). В організмі утворюються продукти окислення сірки - політіонові кислоти із загальною формулою H 2 S x O 6 ( х = 3-6)
S + O 2 → H 2 S x O 6
Сірка - досить активний неметалл. Навіть при невеликому нагріванні вона окисляє багато простих речовини, однак і сама легко окислюється киснем і галогенами (окислювально-відновна двоїстість).
Ступінь окислювання -2 сірка виявляє в сірководні і його похідних - сульфідах.
Сірководень (діводородсульфід)часто зустрічається в природі. Міститься в так званих сірчаних мінеральних водах. Це безбарвний газ з неприємним запахом. Утворюється при гнитті рослинних і, особливо, тварин залишків під дією мікроорганізмів. Деякі фотосинтезирующие бактерії, наприклад зелені сірчані бактерії, як донора водню використовують діводородсульфід. Ці бактерії замість кисню О2 виділяють елементну сірку - продукт окислення Н 2 S.
Діводородсульфід - вельми токсична речовина, так як є інгібітором ферменту цитохромоксидази - переносника електронів в дихальної ланцюга. Він блокує перенесення електронів з цитохромоксидази на кисень О2.
Водні розчини Н 2 S дають слабокислу реакцію по лакмусу. Відбувається іонізація за двома ступенями:
Н 2 S ⇄ Н + + НS - (I ступінь)
НS - ⇄ Н + + S 2- (II ступінь)
Сірководнева кислота дуже слабка. Тому іонізація по другого ступеня протікає тільки в дуже розведених розчинах.
Солі сірководневої кислоти називаються сульфідами.У воді розчинні сульфіди тільки лужних, лужноземельних металів і амонію. Кислі солі - гідросульфіди Е + НS і Е 2 (НS) 2 - відомі тільки для лужних і лужноземельних металів
Будучи солями слабкої кислоти, сульфіди піддаються гідролізу. Гідроліз сульфідів багатозарядних катіонів металів (Аl 3+, Сr 3 + і ін.) Часто доходить до кінця, він практично незворотній.
Сульфіди, особливо сірководень, є сильними відновниками. Залежно від умов вони можуть окислюватися до S, SО 2 або Н 2 SО 4:
2Н 2 S + 3О 2 = 2SО 2 + 2Н 2 О (на повітрі)
2Н 2 S + О 2 = 2Н 2 О + 2S (на повітрі)
3Н 2 S + 4НСlO 3 = 3Н 2 SО 4 + 4НСl (в розчині)
Деякі білки, що містять цистеїн НSСН 2 СН (NН 2) СООН і важливий метаболіт кофермент А, мають водородсульфідние (тіоловою) групи -SН, в ряді реакцій поводяться як біонеорганічної похідні діводородсульфіда. Білки, що містять цистеїн, так само, як і діводородсульфід, можна окислити йодом. За допомогою дисульфидного містка, що утворюється при окисленні тіолових груп, цистеїнові залишки поліпептидних ланцюгів з'єднують ці ланцюги поперечної зв'язком (утворюється зшивання).
Багато сірковмісні ферменти Е-SН необоротно отруюються іонами важких металів, такими, як Сu 2+ або Аg +. Ці іони блокують тіольний групи з утворенням меркаптанів, біонеорганічної аналогів сульфідів:
Е-SН + Аg + → Е-S-Аg + Н +
В результаті фермент втрачає активність. Спорідненість іонів Аg + до тіольний групам настільки велике, що АgNО 3 можна використовувати для кількісного визначення-SН-груп методом титрування.
Оксид сірки (IV) SO 2 є кислотним оксидом. Його отримують спалюванням елементної сірки в кисні або випалюванням піриту FеS 2:
S + О 2 = SО 2
4FеS 2 + 11О 2 = 2Fе 2 О 3 + 8SО 2
SО 2 - газ з задушливим запахом; вельми отруйний. При розчиненні SО 2 в воді утворюється сірчиста кислотаН 2 SО 3. Ця кислота середньої сили. Сірчиста кислота, будучи двухосновной, утворює солі двох типів: середні - сульфіти(Nа 2 SО 3, К2 SО 3 і ін.) І кислі - гідросульфіти(NаНSО 3, КНSО 3 і ін.). У воді розчинні лише солі лужних металів і гідросульфіти типу Е 2 (НSО 3) 2, де Е - елементи різних груп.
Для оксиду SО 2, кислоти Н 2 SОз і її солей характерна окислювально-відновна двоїстість, так як сірка має в цих з'єднаннях проміжну ступінь окислення +4:
2Nа 2 SО 3 + О 2 = 2Nа 2 SО 4
SО 2 + 2Н 2 S = 3S ° + 2Н 2 O
Однак відновні властивості у сполук сірки (IV) переважають. Так, сульфіти в розчинах окислюються навіть дікіслородом повітря при кімнатній температурі.
На вищих тварин оксид SO 2 діє перш за все як подразник слизової оболонки дихальних шляхів. Токсичний цей газ і для рослин. У промислових районах, де спалюється багато вугілля, що містить невелику кількість з'єднань сірки, в атмосферу виділяється сірка діоксид. Розчиняючись у волозі, що знаходиться на листі, SО 2 утворює розчин сірчистої кислоти, який, в свою чергу, окислюється до сірчаної кислоти Н 2 SО 4:
SО 2 + Н 2 О = Н 2 SО 3
2Н 2 SО 3 + О 2 = 2Н 2 SО 4
Атмосферна волога з розчиненими SО 2 і Н 2 SО 4 випадає нерідко у вигляді кислотних дощів, що приводять до загибелі рослинності.
При нагріванні розчину Nа 2 SО 3 з порошком сірки утворюється натрій тіосульфат:
Nа 2 SО 3 + S = N а 2 S 2 О 3
З розчину виділяється кристаллогидрат Nа 2 S 2 О 3 ∙ 5Н 2 О. Натрій тіосульфат - сіль тіосерной кислотиН 2 S 2 О 3.
Тіосерная кислота дуже нестійка і розкладається на Н 2 О, SО 2 і S. Натрій тіосульфат Nа 2 S 2 О 3 ∙ 5Н 2 О застосовують в медичній практиці як протівотоксіческое, протизапальну і десенсибілізуючу засіб. Як протівотоксіческое засіб, натрій тіосульфат використовують при отруєннях сполуками ртуті, свинцю, синильною кислотою та її солями. Механізм дії препарату, очевидно, пов'язаний з окисленням тіосульфат-іона до сульфит-іона і елементної сірки:
S 2 О 3 2 → SО 3 2 + S °
Іони свинцю і ртуті, що потрапляють в організм з їжею або повітрям, утворюють погано розчинні нетоксичні сульфіти:
Рb 2+ + SO 3 2- = РbSO 3
Ціанід-іони взаємодіють з елементної сірої, утворюючи менш отруйні тіоціанати:
СN - + S ° = NСS -
Застосовують натрій тіосульфат і для лікування корости. Після втирання в шкіру розчину роблять повторні втирання 6% -ного розчину НСl. В результаті реакції з НСl натрій тіосульфат розпадається на сірку і діоксид сірки:
Nа 2 S 2 О 3 + 2НСl = 2NaСl + SО 2 + S + Н 2 О
які і надають згубну дію на коростявих кліщів.
оксид сірки (VI) SО 3 - летюча рідина. При взаємодії з водою SО 3 утворює сірчану кислоту:
SО 3 + Н 2 О = Н 2 SО 4
Структура молекул сірчаної кислоти відповідає сере в sр 3 -гібридному стані.
Сірчана кислота - сильна двухосновная кислота. За першого ступеня вона іонізована практично повністю:
Н 2 SО 4 ⇄ Н + + НSО 4 -,
Іонізація по другого ступеня протікає в меншій мірі:
НSО 4 - ⇄ Н + + SО 4 2-,
Концентрована сірчана кислота - сильний окислювач. Вона окисляє метали і неметали. Зазвичай продуктом її відновлення є SО 2, хоча в залежності від умов проведення реакції (активності металу, температури, концентрації кислоти) можуть виходити і інші продукти (S, Н 2 S).
Будучи двухосновной кислотою, Н 2 SО 4 утворює два типи солей: середні - сульфати(Na 2 SO 4 і ін.) І кислі - гидросульфати(NаНSО 4, КНSО 4 і ін.). Більшість сульфатів добре розчиняються у воді Багато сульфати виділяються з розчинів у вигляді кристалогідратів: FеSО 4 ∙ 7Н 2 О, СuSО 4 ∙ 5Н 2 О. До практичнонерозчинним відносяться сульфати ВаSО 4, SrSО 4 і РbSО 4. Малорастворим кальцій сульфат СаSО 4. Барій сульфат не розчиняється не тільки у воді, але і в розбавлених кислотах.
У медичній практиці сульфати багатьох металів застосовують в якості лікарських засобів Na 2 SO 4 ∙ 10Н 2 О - як проносне, MgSО 4 ∙ 7Н 2 О - при гіпертонії, як проносне і як жовчогінний засіб, мідний купорос СuSО 4 ∙ 5Н 2 О і ZnSО 4 ∙ 7Н 2 О - як антисептичні, в'яжучі, блювотні засоби, барій сульфат ВаSО 4 - як контрастну речовину при рентгенологічному дослідженні стравоходу і шлунка
Сполуки селену і телуру.За хімічними властивостями телур і особливо селен схожі на сірку. Однак посилення металевих властивостей у Sе і Ті підвищує їх схильність до утворення більш міцних іонних зв'язків. Подібність фізико-хімічних характеристик: радіусів іонів Е 2, координаційних чисел (3, 4) - обумовлює взаімозамещаемость селену і сірки в з'єднаннях. Так, селен може заміщати сірку в активних центрахферментів. Заміна водородсульфідной групи -SН на водородселенідную групу -SеН змінює перебіг біохімічних процесів в організмі. Селен може виступати як синергистом, так і антагоністом сірки.
З воднем Sе і Ті утворюють аналогічні Н 2 S дуже отруйні гази Н 2 Sе і Н 2 Те. Діводородселенід і діводородтеллурід є сильними відновниками. В ряду Н 2 S-Н 2 Sе-Н 2 Ті відновна активність зростає.
Для Н 2 Sе виділені як середні солі - селеніди(Nа 2 Sе і ін.), Так і кислі солі - гідроселеніди(NaНSе і ін.). Для Н 2 Ті відомі тільки середні солі - теллуріди.
З'єднання Sе (IV) і Ті (IV) з киснем на відміну від SО 2 - тверді кристалічні речовини SЕО 2 і Тео 2.
селениста кислотаН 2 SЕО 3 і її солі селеніти,наприклад Nа 2 SЕО 3, - окислювачі середньої сили. Так, у водних розчинах вони відновлюються до селену такими восстановителями, як SО 2, Н 2 S, НI і ін .:
Н 2 SЕО 3 + 2SО 2 + Н 2 О = Sе + 2Н 2 SО 4
Очевидно, що легкість відновлення селеніту до елементного стану обумовлює утворення в організмі біологічно активних селенсодержащих з'єднань, наприклад селеноцистеїну.
SЕО 3 і Тео 3 - кислотні оксиди. Кисневі кислоти Sе (VI) і Ті (VI) - селеноваяН 2 SЕО 4 і телуровоїН 6 Тео 6 - кристалічні речовини з сильними окисними властивостями. Солі цих кислот називаються відповідно селенатамиі теллуратов.
В живих організмах селенатов і сульфати - антагоністи. Так, введення сульфатів призводить до виведення з організму надлишкових селенсодержащих з'єднань.
§8 Елементи VI А групи.
Кисень, сірка, селен, телур, полоній.
Загальні відомості елементів VI А групи:
Елементи VI А групи (крім полонію) називаються халькогенідів. На зовнішньому електронному рівня цих елементів знаходяться шість валентних електронів (ns2 np4), тому вони в нормальному стані проявляють валентність 2, а в збудженому -4 або 6 (крім кисню). Атом кисню відрізняється від атомів інших елементів підгрупи відсутністю d-підрівні в зовнішньому електронному шарі, що обумовлює великі енергетичні витрати на «розпарювання» його електронів, некомпенсируемое енергією утворення нових ковалентних зв'язків. Тому ковалентность кисню дорівнює двом. Однак в деяких випадках атом кисню, що володіє неподіленими електронними парами, може виступати в якості донора електронів і утворювати додаткові ковалентні зв'язку за донорно-акцепторного механізму.
Електронегативність цих елементів поступово зменшується в порядку О-S-Se-Ті-Ро. Cтепень окислення від -2, + 2, + 4, + 6. Збільшується радіус атома, що послаблює неметалеві властивості елементів.
Елементи цієї підгрупи утворюють з воднем сполуки виду H2 R (H2 О, H2 S, H2 Se, H2 Ті, H2 Ро) Ці сполуки розчиняючись у воді, утворюють кислоти. Кислотні властивості збільшуються в напрямку H2 Про → H2 S → H2 Se → H2 Ті → H2 Ро. S, Se і Ті утворюють з киснем з'єднання типу RO2 і RO3. З цих оксидів утворюються кислоти типу H2 RO3 і H2 RO4. Зі збільшенням порядкового номера, сили кислот зменшуються. Всі вони мають окислювальні властивості. Кислоти типу H2 RO3 виявляють і відновні властивості.
кисень
Природні сполуки та отримання:Кисень - найпоширеніший елемент земної кори. У вільному стані він знаходиться в атмосферному повітрі (21%); в пов'язаному вигляді входить до складу води (88,9%), мінералів, гірських порід і всіх речовин, у тому числі побудовано організми рослин і тварин. Атмосферне повітря являє собою суміш багатьох газів, основну частину якої складають азот і кисень, і невелика кількість благородні гази, вуглекислий газ і водяну пару. Вуглекислий газ утворюється в природі при горінні дерева, вугілля та інших видів палива, диханні тварин, гнитті. У деяких місцях земної кулі CO2 виділяється в повітря внаслідок вулканічної діяльності, а також з підземних джерел.
Природний кисень складається з трьох стабільних ізотопів: 816 О (99,75%), 817 О (0,04), 818 О (0,20). Штучним шляхом були також отримані ізотопи 814 О, 815 О, 819 О.
Кисень був отриманий вперше в чистому вигляді К.В.Шееле в 1772 р, а потім в 1774 р Д.Ю.Прістлі, який виділив його з HgO. Однак Прістлі не знав, що отриманий їм газ входить до складу повітря. Тільки через кілька років Лавуазьє, докладно вивчив властивості цього газу, встановив, що він є основною частиною повітря.
У лабораторії кисень виходить наступними методами:
Е
лектролізом води.Щоб збільшити електропровідність води в неї додають розчин лугу (зазвичай 30% -ий KOH) чи сульфати лужних металів:
У загальному вигляді: 2H2 Про → 2H2 + О2
На катоді: 4H2 Про + 4e¯ → 2H2 + 4OH¯
На аноді: 4OH-4е → 2H2 Про + О2
- Розкладанням кисневмісних сполук:
Термічний розклад бертолетової солі під дією каталізатора MnO2.
KClO3 → 2KCl + 3О2
Термічний розклад перманганату калію
KMnO4 → K2 MnO4 + MnO2 + О2.
Термічний розклад нітратів лужних металів:
2KNO3 → 2KNO2 + О2.
Розкладанням пероксидов:
2H2 О2 → 2H2 Про + О2.
2ВаО2 → 2ВаО + О2.
Термічним розкладанням оксиду ртуті (II):
2HgO → 2HgO + О2.
Взаємодією пероксидов лужних металів з оксидом вуглецю (IV):
2Na2 О2 + 2CO2 → 2Na2 CO3 + О2.
Термічним розкладанням хлорного вапна в присутності каталізатора - солей кобальту:
2Ca (OCl) Cl → 2CaCl2 + О2.
Окисленням пероксиду водню перманганатом калію в кислому середовищі:
2KMnO4 + H2 SO4 + 5H2 О2 → K2 SO4 + 2Mn SO4 + 8H2 Про + 5О2.
У промисловості:В даний час в промисловості кисень одержують фракційною перегонкою рідкого повітря. При слабкому нагріванні рідкого повітря з нього спочатку відділяється азот (t кип (N2) = - 196ºC), потім виділяється кисень (t кип (О2) = - 183ºС).
Кисень отриманий цим способом містить домішки азоту. Тому для отримання чистого кисню отриману суміш заново дистилюють і в кінцевому підсумку виходить 99,5% кисень. Крім того деяку кількість кисню отримують електролізом води. Електролітом служить 30% розчин KOH.
Кисень зазвичай зберігають в балонах синього кольору під тиском 15МПа.
фізико Хімічні властивості: Кисень - газ без кольору, запаху, смаку, трохи важчий за повітря, слабо розчиняється у воді. Кисень при тиску 0,1 МПа і температурі -183ºС переходить в рідкий стан, при -219ºС замерзає. У рідкому і твердому стані притягується магнітом.
Згідно з методом валентних зв'язків будова молекули кисню, представлене схемою -: Ö :: Ö: , не пояснює велику міцність молекули, що має паромагнітние властивості, тобто неспарені електрони в нормальному стані.
В результаті зв'язку електронів двох атомів утворюється одна загальна електронна пара, після цього неспарених електронів в кожному атомі утворює взаємний зв'язок з нерозділеного парою іншого атома і між ними утворюється трьох електронний зв'язок. У збудженому стані молекула кисню проявляє діамагнітниє властивості, яким відповідає будова за схемою: Ö = Ö: ,
Для заповнення електронного рівня в атомі кисню не вистачає двох електронів. Тому кисень в хімічних реакціяхможе легко приєднувати два електрони і проявляти ступінь окислення -2. Кисень тільки в з'єднаннях з більш електронегативний елементом фтором проявляє ступінь окислення +1 і +2: О2 F2, ОF2.
Кисень - сильний окислювач. Він не взаємодіє тільки з важкими інертними газами (Kr, Xe, He, Rn), з золотом і платиною. Оксиди цих елементів утворюються іншими шляхами. Кисень входить в реакції горіння, окислення як з простими речовинамитак і зі складними. При взаємодії неметалів з киснем утворюються кислотні або соленеобразующіе оксиди, а при взаємодії металів утворюються амфотерні або змішані оксиди Так, з фосфором кисень реагує при температурі ~ 60 ° С,
4P + 5О2 → 2Р2 ПРО5
З металламі- оксиди відповідних металів
4Al + 3O2 → 2Al2 O3
3Fe + 2O2 → Fe3 O4
при нагріванні лужних металів в сухому повітрі тільки літії утворює оксид Li2 O, а решта-пероксиди і супероксиди:
2Na + O2 → Na2 O2 K + O2 → KO2
З воднем кисень взаємодіє при 300 ° С:
2Н2 + О2 = 2Н2 О.
При взаємодії з фтором він проявляє відновні властивості:
O2 + F2 = F2 O2 (в електричному розряді),
з сіркою - при температурі близько 250 ° С:
З графітом кисень реагує при 700 ° С
З + О2 = СО2.
Взаємодія кисню з азотом починається лише при 1200 ° С або в електричному розряді:
N2 + О22NО - Q.
Кисень реагує і з багатьма складними сполуками, наприклад, з оксидом азоту (II) він реагує вже при кімнатній температурі:
2NО + О2 = 2NО2.
При окисленні сірководню, при нагріванні, утворюється сірка, або оксид сірки (IV) в залежності від співвідношення між кисню і сірководню:
2Н2 S + О2 = 2S + 2Н2 Про
2Н2 S + ЗО2 = 2SО2 + 2Н2 Про
У більшості реакцій окислення за участю кисню виділяється тепло і світло - такі процеси називаються горінням.
озон
Озон-O3-друга аллотропная модифікація елемента кисню. Молекула O3 має кутову будову (кут між зв'язками 116º, довжина зв'язку О = О, l = 0,1278нм) При н.у. це газ синього кольору. Рідкий озон- темно-синього кольору. Він отруйний і вибухових особливо в рідкому і твердому стані). Озон утворюється в атмосфері при грозових розрядах, і має специфічний запах свіжості.
Зазвичай озон отримують в озонаторах пропусканням тихого електричного розряду через кисень (реакція ендотермічна і сильно оборотна; вихід озону складає 5%):
3О22О3? Н = -285 кДж. У лабораторних умовах озон отримують при підкисленні азотною кислотою персульфата
(NH4) 2 S2 O8 → H2 S2 O8 + 2NH4 +
H2 S2 O8 → 2SO2 + O3 + H2 O
O3 утворюється з невеликим виходом в результаті реакції:
3F2 + H2 O (г) → 6HF + O3
O3-сильно окислювач, окисляє всі метали, (крім золота і платинових металів) і більшість неметалів. Він переводить нижчі оксиди до вищих, а сульфіди металів-в їх сульфати. В реакціях за участю О3 зазвичай утворюється О2, наприклад:
2Ag + O3 → Ag2 O + O2
PbS + 4O3 → PbSO4 + 4O2
NH2 + 3O3 → HNO2 + H2 O
Pb (OH) 2 + O3 → PbO2 + H2 O + O2
При впливі O3 на лужні метали можна отримати озоніди- нестійкі сполуки, які розкладаються:
2KO3 → 2KO2 + O2
Як сильний окислювач, озон вбиває бактерії і тому застосовується для дезінфекції повітря. Стійкий шар озону знаходиться в атмосфері на висоті ~ 22км. Цей озоновий шар захищає Землю від згубного для життя чистого ультрафіолетового випромінювання.
При взаємодії озону з розчином йодиду калію виділяється йод, тоді як з киснем ця реакція не йде:
2КI + О3 + Н2 О = I2 + 2КОН + О2.
Реакція часто використовується як якісна для виявлення іонів I - або озону. Для цього в розчин додають крохмаль, який дає характерний синій комплекс з виділився йодом, причому якісна ще й тому, що озон, що не окислюється іони Сl - і Br-.
вода
Фізичні та хімічні властивості води:Чиста вода є есцветную, без смаку, запаху, прозору рідину. Щільність води при переході їїз твердого стану в рідке не зменшується, як майже у всіх інших речовин, а зростає.
Вода-речовина звичне і незвичайне. Немає на землі речовини, більш важливого для нас, ніж звичайна вода, і в той же час не існує іншої речовини, у властивостях якого було б стільки протиріч та аномалій, скільки в її властивостях.
Майже ¾ поверхні нашої планети зайнято океанами і морями. Твердою водою-снігом і льдом- покрито 20% суші. Від води залежить клімат планети. Геофізики стверджують, що Земля давно б охолола і перетворилася в неживий шматок каменю, якби не вода. У неї дуже велика теплоємність. Нагріваючись, вона поглинає тепло, охолоджуючись, віддає його. Земна вода і поглинає і повертає дуже багато тепла, тим самим вирівнює клімат. Від космічного холоду оберігають Землю ті молекули, які розсіяні в атмосфере- в хмарах і у вигляді пари.
Вода за фізичними властивостями істотно відрізняється від інших розчинників: При 4ºС вода має максимальну щільність, і лише при подальшому нагріванні її щільність зменшується. Якби при зниженні температури і при переході з рідкого стану в тверде вода змінювалася аналогічно іншим речовинам, то при наближенні зими поверхневі шари природних вод охолола б до 0ºС і опускалися на дно до тих пір, поки вся маса водойми не набула б температуру 0 ° С. Вода замерзала б, крижини занурювалися на дно, і водойма промерзав б на всю глибину. Багато форм життя у воді були б неможливі. Насправді охолоджений шар, що володіє меншою щільністю, залишається на поверхні, замерзає і тим самим захищає лежачі нижче шари від охолодження.
Вода має аномально високій теплоємності (4,18 Дж / г ∙ К), тому в нічний час, а також при переході від літа до зими, вода остигає повільно. А днем, або при переході від зими до літа, так само повільно нагрівається, будучи, таким чином регулятором температури на земній кулі.
Вода при звичайному стані є рідиною, в той час як H2 S, H2 Se, H2 Te- гази. Температури кристалізації і випаровування води значно вище відповідних температур зазначених сполук.
Вода має дуже високу діелектричної проникністю (78.5 при 298К).
Вода-хорошийрозчинник полярних рідин і з'єднань з іонними зв'язками, утворює кристалогідрати з багатьма хімічними сполуками.
Довгий час незвичайні властивості води були загадкою для вчених. Вони в основному обумовлені наступними причинами:
Полярний характер молекул;
Наявність не поділених електронних пар у атома кисню;
Водневі зв'язки.
Зв'язок між атомами водню і кисню полярна, що призводить до асиметрії в розподілі електронних зарядів і, отже, до полярності молекули. Довжина зв'язку становить 96 нм, а кут між зв'язками ~ 105º.
Наявність неподіленого пар електронів у кисню і зміщення обобществленних електронних пар від атомів водню до кисню обумовлюють утворення водневих зв'язків. Енергія зв'язку дорівнює 25 кДж / моль. Атом кисню в молекулі води перебуває в стані sp3-гібридизації. Тому валентний кут НОН близький до тетраедіческому кутку (109,5º).
Молекулярна маса пароподібний води дорівнює 18 і відповідає її простій формулі. Однак молекулярна маса рідини виявляється вищою. Це свідчить про те, що в рідкій фазі відбувається асоціація молекул, тобто з'єднання їх в більш складні агрегати, внаслідок утворення між молекулами водневих зв'язків.
У твердій воді (лід) атом кисню кожної молекули бере участь в утворенні двох водневих зв'язків з сусідніми молекулами води.
Структура льоду належить до найменш щільним структурам, в ній існують пустки, розміри яких дещо перевищують розміри молекули води. При плавленні льоду його структура руйнується, а й в рідкій фазі зберігаються водневі зв'язки, утворюються асоціати, проте вони існують короткий час: постійно відбувається руйнування одних і утворення інших агрегатів. У порожнинах таких «крижаних» агрегатів можуть розміщуватися поодинокі молекули води, при цьому упаковка молекул води стає щільною. Саме тому при плавленні льоду об'єм, займаний водою, зменшується, а її щільність зростає. При нагріванні води частина теплоти витрачається на розрив водневих зв'язків. Цим пояснюється висока теплоємність води. Водневі зв'язки між молекулами води повністю розриваються тільки при переході води в пару.
На Землі 6800 атомів протію доводиться один атом дейтерію, а в межзвездочном просторі один атом дейтерію доводиться вже на 200 атомів протію.
Вода-дуже реакційно речовина.
Вода реагує з багатьма металамиз виділенням водню:
2Na + 2H2 O = H2 + 2NaOH (бурхливо)
2K + 2H2 O = H2 + 2KOH (бурхливо)
3Fe + 4H2 O = 4H2 + Fe3 O4 (тільки при нагріванні)
Не всі, а тільки досить активні металиможуть брати участь в окисно-відновних реакціях цього типу. Найбільш легко реагують лужні і лужноземельні метали.
з неметалівз водою реагують, наприклад, вуглець і його водневе з'єднання (метан). Ці речовини набагато менш активні, ніж метали, але все ж здатні реагувати з водою при високій температурі:
C + H2 O ® H2 + CO
CH4 + 2H2 O ® 4H2 + CO2
Вода розкладається на водень і кисень при дії електричного струму. Це також окисно-відновна реакція, де вода є одночасно і окислювачем, і відновником:
2H2 O ![]() 2H2 + O2
2H2 + O2
Вода реагує з багатьма оксидами неметалів. На відміну від попередніх, ці реакції не окислювально-відновні, а реакції з'єднання:
P2 O5 + 3H2 O → 2H3 PO4; N2 O5 + H2 O → 2HNO3
Оксиди лужних і щелоочно-земельних металів вступають в реакції з'єднання з водою з утворенням відповідних лугів:
CaO + H2 O → Ca (OH) 2
Не всі оксиди металів здатні реагувати з водою. Частина з них практично не розчинна у воді і тому з водою не реагує. Це ZnO, TiO2, Cr2 O3, з яких готують, наприклад, стійкі до води фарби. Оксиди заліза також не розчинні у воді і не реагують з нею. Багато з'єднання металів з неметалами легко взаємодіють з водою з утворенням відповідних гідроксидів металів і водневих сполук неметалів:
PCl3 + 3H2 O → H3 PO3 + 3HCl
Al2 S3 + 6H2 O → 2Al (OH) 3 + 3H2 S
Ca3 P2 + 6H2 O → 3Ca (OH) 2 + 2PH3
Na3 N + 3H2 O → 3NaOH + NH3
KH + H2 O → KOH + H2
Вода утворює численні з'єднання, в яких її молекула повністю зберігається. Це так звані гідрати. Якщо гідрат кристалічний, то він називається кристалогідрат, Наприклад:
CuSO4 +5 H2 O → CuSO4 . 5H2 O
H2 SO4 + H2 O = H2 SO4 . H2 O (гідрат сірчаної кислоти)
NaOH + H2 O = NaOH . H2 O (гідрат їдкого натру)
З'єднання, що зв'язують воду в гідрати і кристалогідрати, використовують в якості осушувачів. З їх допомогою, наприклад, видаляють водяні пари з вологого атмосферного повітря.
Особлива реакція води-фотосинтез - синтез рослинами крохмалю (C6 H10 O5) n і інших подібних з'єднань (вуглеводів), яка відбувається з виділенням кисню:
6n CO2 + 5n H2 O = (C6 H10 O5) n + 6n O2 (при дії світла)
Вода володіє каталітичної активністю. У відсутності слідів вологи практично не протікають звичайні реакції, наприклад, не окислюється натрій, білий фосфор, хлор не взаємодіє з металами, фторводород не ріже скло.
Перекис водню
Пероксид водню H2 O2 - сполука водню c киснем, що містить рекордну кількість кисню - 94% по масі. У молекулах Н2 О2 містяться пероксидні групи -О-О-які багато в чому визначають властивості цього з'єднання.
Через несиметричного розподілу зв'язків Н-О молекула Н2 О2 сильно полярна. Між молекулами Н2 О2 виникає досить міцна воднева зв'язок, що призводить до їх асоціації. Тому в звичайних умовах пероксид водорода- сиропообразная рідина блідо-блакитного кольору (щільність 1,44) з досить високою температуроюкипіння (150ºС). При зберіганні Н2 О2 розкладається.
Селен отримують з відходів сірчанокислотного, целюлозно-паперового виробництва та анодних шламів електролітичного рафінування міді. У шламах селен присутній разом із сіркою, телуром, важкими і благородними металами. Для вилучення селену шлами фільтрують і піддають або окислювальному випалу (близько 700 ° С), або нагрівання з концентрованою сірчаною кислотою. Утворений летючий SeO2 вловлюють в скрубберах і електрофільтрах. З розчинів технічний селен осаджують сірчистим газом. Застосовують також спікання шламу з содою з подальшим вилуговуванням селената натрію водою і виділенням з розчину селену. Для отримання селену високої чистоти, що використовується в якості напівпровідникового матеріалу, чорновий селен рафінують методами перегонки у вакуумі, перекристалізації і іншими.
Фізичні та хімічні властивості селену.Конфігурація зовнішньої електронної оболонки атома Se 4s2 4p4; у двох p-електронів спини спарені, а у інших двох - НЕ спарені, тому атоми селену здатні утворювати молекули Se2 або ланцюжка атомів Sen. Ланцюги атомів селену можуть замикатися в кільцеві молекули Se8. Різноманітність молекулярного будови обумовлює існування селену в різних аллотропических модифікаціях: аморфної (порошкоподібний, колоїдний, склоподібний) і кристалічної (моноклінний α- і β-форми і гексагональний γ-форми). Аморфний (червоний) порошкоподібний і колоїдний селен (щільність 4,25 г / см3 при 25 ° С) отримують при відновленні з розчину селенистой кислоти H2 SeO3, швидким охолодженням парів селену і іншими способами. Склоподібний (чорний) селен (щільність 4,28 г / см3 при 25 ° С) отримують при нагріванні різних модифікацій селену вище 220 ° С з наступним швидким охолодженням. Склоподібний селен має скляним блиском, крихкий. Термодинамічно найбільш стійкий гексагональний (сірий) селен. Він виходить з інших форм селену нагріванням до плавлення з повільним охолодженням до 180-210 ° С і витримкою при цій температурі. Решітка був збудований з розташованих паралельно спіральних ланцюжків атомів. Атоми всередині ланцюгів пов'язані ковалентно. Всі модифікації селену володіють фотоелектричними властивостями. Гексагональний селен аж до температури плавлення - домішковий напівпровідник з доречнийпровідністю. Селен - діамагнетик (пари його парамагнітни).
На повітрі селен стійкий; кисень, вода, соляна і розбавлена сірчана кислоти на нього не діють, добре розчинний в концентрованої азотної кислоти і царській горілці, в лугах розчиняється діспропорціоніруя:
Se + 4HNO3 → H2 SeO3 + 4NO2 + H2 O
3Se + 6KOH → K2 SeO3 + 2K2 Se + 3H2 O
Селен в з'єднаннях має ступені окислення -2, + 2, + 4, +6. З киснем селен утворює ряд оксидів: SeO, Se2 O3, SeO2, SeO3. Два останніх є ангідридами селенистой H2 SeO3 і селеновой H2 SeО4 кислот (солі -селеніти і селенатов). Найбільш стійкий SeO2. SeO2 і H2 SeO3 з сильними окислювачами проявляють відновні властивості:
3H2 SeO3 + HClO3 → 3H2 SeO4 + HCl
З галогенами селен дає з'єднання SeF6, SeF4, SeCl4, SeBr4, Se2 Cl2 та інші. Сірка і телур утворюють безперервний ряд твердих розчинів з селеном. З азотом селен дає Se4 N4, з вуглецем -CSe2. Відомі сполуки з фосфором Р2 Sе3, Р4 Sе3, P2 Se5. Водень взаємодіє з селеном при t> = 200 ° С, утворюючи H2 Se; розчин H2 Se у воді називається селеноводородной кислотою. При взаємодії з металами селен утворює селеніди. Отримано численні комплексні сполуки селену. Всі сполуки селену отруйні.
застосування селену .Завдяки дешевизні і надійності селен використовується в перетворювальної техніки в випрямних напівпровідникових діодах, а також для фотоелектричних приладів (гексагональний), електрофотографічних копіювальних пристроїв (аморфний селен), синтезу різних селенидов, як люмінофори в телебаченні, оптичних і сигнальних приладах, терморезистор і т. п. селен широко застосовується для знебарвлення зеленого скла і отримання рубінових стекол; в металургії - для додання литої сталі дрібнозернистої структури, поліпшення механічних властивостей нержавіючих сталей; в хімічній промисловості - як каталізатор; використовується селен також у фармацевтичній промисловості та інших галузях.
8.4 Телур
Природні сполуки та отримання.Основні. джерела телуру-шлами електролітичного рафінування міді і шлами сірчанокислотного виробництва, а також лужні Дросс рафінування свинцю. При переробці сірчанокислотних шламів методом випалу (див. Селен) телур залишається в огарки, який виділяють соляною кислотою. З солянокислого розчину пропусканням SO2 осаджують Se, після чого розчин розбавляють до вмісту кислоти 10-12% і при нагріванні дією SO2 осаджують телур.
При спіканні шламів з содою і подальшим вилуговування телур переходить в р-р і при нейтралізації осідає у вигляді ТеО2. Телур отримують або прямим відновленням ТеО2 вугіллям, або осадженням при дії SO2 на солянокислий розчини ТеО2. При переробці шламів сульфідним методом (вилуговування розчином Na2 S) телур виділяють з розчину (після осадження Se аерацією) дією сухого Na2 S2 O3:
Na2 TeS3 + 2Na2 SO3 → Ті + 2Na2 S2 O3 + Na2 S
При переробці медеелектролітних шламів телур в основному переходить в содові шлаки, що виходять при переплавки залишків на золото-срібний сплав ( «метал Доре»). При використанні сульфатізаціі частина теллура переходить в сульфатні розчини разом з Сі. З них телур осаджують дією металевої міді:
Н2 ТеО3 + 4H2 SO4 + 6Сu → Ті + Си2 Ті + 4CuSO4 + 6Н2 Про
З содових шлаків телур витягають після розчинення у воді або нейтралізацією з осадженням ТеО2 (його очищають переосажденіем з сульфідних або кислих розчинів, розчиняють в луги і виділяють телур електролізом), або прямо з содового розчину електролізом осаджують чорновий телур. Його відновлюють А1 в лужному розчині:
6Те + 2А1 + SNaOH → 3Na2 Te2 + 2NaAlO2 + 4Н2 О. Потім телур осаджують аерацією:
2Na2 Te2 + 2Н2 О + О2 → 4Те + 4NaOH
Для отримання телуру високої чистоти використовують його леткі сполуки, зокрема ТеСl4, який очищають дистиляцією або ректифікацією і екстракцією з солянокислого розчину. Після гідролізу хлориду ТеО2 відновлюють Н2. Іноді для очищення використовують також Н2 Ті. На завершальних стадіях очищення застосовують вакуумну сублімацію, дистиляцію або ректифікацію телуру, а також зонний плавку або спрямовану кристалізацію.
Фізичні та хімічні властивості.Телур-сріблясто-сіра речовина з металевим блиском, у тонких шарах на просвіт-червоно-коричневого кольору, в парах-золотисто-жовтий. Розплав теллура вище ~ 700 ° С має металевою провідністю. Телур диамагнитен, магн. сприйнятливість - 0,31 · 10-9. Твердість по Моосу 2,3, по Брінеллю 180-270 МПа; опір розриву 10,8 МПа. Телур крихкий, при нагріванні стає пластичним.
Для теллура нормальний електродний потенціал 0,56 В. Телур, навіть дисперсний, стійкий на повітрі, але при нагріванні горить (полум'я блакитне із зеленим ореолом) з утворенням ТеО2. Кристалічний телур реагує з водою вище 100 ° С, аморфний-вище 50 ° С. Концентровані розчини лугів розчиняють телур з утворенням теллуридов і телуриту. Соляна кислота і розбавлена H2 SO4 на телур не діють, конц. H2 SO4 розчиняє його, що утворюються червоні розчини містять катіон. HNO3 окисляє телур до теллурістий кислоти Н2 ТеО3 (солі-телуриту):
Te + HNO3 → H2 TeO3 + 4NO2 + H2 O
Сильними окислювачами (HСlО3, КМnО4 і ін.) Окислюється до телурової кислоти Н2 ТеО4 (солі-теллуратов):
4Te + 3HClO4 + 4H2 O → 4H2 TeO4 + 3HCl
Te + 3H2 O2 → H2 TeO4 + 2H2 O
Телур розчиняється в розчинах сульфідів і полісульфідів лужних металів (з утворенням тіотеллурідов і тіо-телуриту). Реагує з розчинами солей Ag. У CS2 розчиняється. З Сl2, F2 і Вr2 реагує при кімнатній т-рі, з I2-прі нагріванні, сплавляється з S, P (з'єднань при цьому не утворює), As (даючи As2 Te3), з Si (з утворенням Si2 Te3 і SiTe), з Se (утворюючи при кристалізації твердих розчинів). З бором і вуглецем безпосередньо не взаємодіє, з СО при нагріванні утворює газоподібний нестійкий карбоніл Тесо. При сплаві з металами отримують теллуріди.
Теллуроводород Н2 Те-безбарвний газ з неприємним запахом; в рідкому стані зеленувато-жовтий, кристалічний-лимонно-жовтий; т. кип. - 2 ° С, т. Пл. - 51 ° С; плотн. 5,81 г / л; для газу; а в сухому повітрі при кімнатній температурі повільно розкладається, у вологому окислюється до телуру; при нагріванні на повітрі горить, даючи ТеО2; розчинність в воді 0,1 М, водний розчин-слабка кислота, К1 2 · 10-3; сильний відновник; отримують взаємодією Аl2 ТЕ3 з соляною кислотою, а також електролізом розчину H2 SO4 з телурової катодом при 0 ° С; застосовують для отримання телуру високої чистоти.
Гексафторид ТеF6 -бесцветний газ; т. пл. - 37,8 ° С, т. Возг. -38,6 ° С; плотн. 10,7 г / л; в сухому повітрі стійкий, не діє на скло; в воді розчиняється, поступово гідролізуючись з утворенням фторотеллурових кислот ТеFn (ОН) 6-n, де n - від 1 до 4, і в кінцевому рахунку телурової кислоти; з фторидами металів утворює сполуки, напр. Ag і Ba; отримують фторированием телуру при нагріванні. Тетрафторид TeF4 -крісталли ромбічної сингонії; т. пл. 129,6 ° С, т. Кип. 194 ° С (з розкладанням); щільність 4,22 г / см3; дуже гігроскопічний, легко гідролізується; з фторидами лужних металів утворює пентафторотеллурати M; отримують дією SeF4 на ТеО2. Фториди теллурафторірующіе агенти.
Тетрахлорид ТеС14 -жовте кристали; т. пл. 224 ° С, т. Кип. 381,8 ° С; плотн. 3,01 г / см3; ур-ня температурної залежності тиску пари \ gp (мм рт. ст.) = 8,791 - - 3941 / T (497 - 653); дуже гігроскопічний, водою гідролізується; в концентрованій НС1 розчин., утворюючи хлоротел-луровую кислоту Н2 ТеС16; з солянокислих розчинів екстрагується трибутилфосфатом і іншими органічними розчинниками; з хлоридами лужних металів утворює гекса- М2 [ТеСl6] і пентахлортел-лурати М [ТеС15], з хлоридами Al, Fe (III), Zr та інші комплекси з катіонами, наприклад, ТеС13; отримують хлоруванням телуру; ТеСl4 -ісходное речовина для отримання телуру високої чистоти. Коричневий дихлорид ТеС12 стійкий в парах і може бути сконденсована в рідину. Отримано також два кристалічних нижчих хлориду-сріблясто-сірий ТЕ2 Сl3 і метастабільний чорний з металевим блиском ТЕ2 Сl.
Осадженням з водних розчинів можна отримати сульфіди TeS2 і TeS3, що розкладаються при нагріванні; відомі TeS7 і Te7 S10. Тіотеллурати (напр., Na2 TeS3) можуть бути отримані розчиненням телуру в розчині полісульфідів лужних металів або сере-в розчинах політеллурідов, а також сплавом. Тіотеллурати-проміжні продукти в деяких процесах вилучення телуру.
Застосування.Найважливіша область застосування телуру-синтез розкладання теллуридов, що володіють напівпровідниковими властивостями. Телур використовують також в металургії для легування чавуну і сталі, Рb, Сu (для підвищення їх механічної і хімічної стійкості). Телур та його сполуки застосовують у виробництві каталізаторів, спец. стекол, інсектицидів, гербіцидів і т.п.
полоній
Природні сполуки та отримання полонію.Радіоактивний хімічний елемент VI групи періодичної системи, аналог телуру. Атомний номер 84. Не має стабільних ізотопів. Відомо 27 радіоактивних ізотопів полонію з масовими числами від 192 до 218, з них сім (з масовими числами від 210 до 218) зустрічаються в природі в дуже малих кількостях як члени радіоактивних рядів урану, торію і актинія, інші ізотопи отримані штучно. Найбільш довгоживучі ізотопи полонію - штучно отримані 209 Ро ( t 1/2 = 102 року) і 208 Ро ( t 1/2 = 2,9 року), а також міститься в Радієвий-уранових рудах 210 Ро ( t 1/2 = 138,4 сут). Вміст у земній корі 210 Ро становить всього 2 · 10-14%; в 1 т природного урану міститься 0,34 г радію і частки міліграма полонію-210. Самий короткоживучий з відомих ізотопів полонію - 21з Ро ( t 1/2 = 3 · 10-7 с). Найлегші ізотопи полонію - чисті альфа-випромінювачі, важчі одночасно випускають альфа- і гамма-промені. Деякі ізотопи розпадаються шляхом електронного захоплення, а найважчі проявляють також дуже слабку бета-активність. Різні ізотопи полонію мають історичні назви, прийняті ще на початку 20 ст., Коли їх отримували в результаті ланцюжка розпадів з «батьківського елемента»: RaF (210 Po), AcC "(211 Po), ThC" (212 Po), RaC " (214 Po), AcA (215 Po), ThA (216 Po), RaA (218 Po).
Полоній-210 синтезують шляхом опромінення нейтронами природного вісмуту (він містить тільки 208 Bi) в ядерних реакторах (проміжно утворюється бета-активний ізотоп вісмуту-210): 208 Bi + n → 210 Bi → 210 Po + e. При опроміненні вісмуту прискореними протонами утворюється полоній-208, його відокремлюють від вісмуту сублімацією у вакуумі - як це робила М.Кюрі. В СРСР методику виділення полонію розробила Зінаїда Василівна Єршова (1905-1995). У 1937 вона була відряджена до Парижа в Інститут радію в лабораторію М. Кюрі (керовану в той час Ірен Жоліо-Кюрі). В результаті цього відрядження колеги стали називати її «російської мадам Кюрі». Під науковим керівництвом З.В.Ершовой в країні було створено постійно діючу, екологічно чисте виробництво полонію, що дозволило реалізувати вітчизняну програму запуску місяцеходів, в яких полоній використовували в якості джерела тепла.
Довгоживучі ізотопи полонію поки не отримали помітного практичного застосування через складність їх синтезу. Для їх отримання можна використовувати ядерні реакції
207 Pb + 4 He ® 208 Po + 3n,
208 Bi + 1 H ® 208 Po + 2n,
208 Bi + 2 D ® 208 Po + 3n,
208 Bi + 2 D ® 208 Po + 2n,
де 4 Чи не - альфа-частинки, 1 Н - прискорені протони, 2 D - прискорені дейтрони (ядра дейтерію).
Властивості полонію.Уже телур частково проявляє металеві властивості, полоній ж - м'який сріблясто-білий метал. Через сильну радіоактивності світиться в темряві і сильно нагрівається, тому потрібен безперервне відведення тепла. Температура плавлення полонію 254 ° С (трохи вище, ніж у олова), температура кипіння 962 ° С, тому вже при невеликому нагріванні полоній переганяється. Щільність полонію майже така ж, як у міді - 9,4 г / см3. У хімічних дослідженнях застосовується тільки полоній-210, більш живучі ізотопи практично не використовуються через складність їх отримання при однакових хімічних властивостях.
Хімічні властивості металевого полонію близькі до властивостей його найближчого аналога - телуру, він проявляє ступені окислення -2, +2, +4, +6. На повітрі полоній повільно окислюється (швидко при нагріванні до 250 ° С) з утворенням червоного діоксиду РоО2 (при охолодженні він стає жовтим в результаті перебудови кристалічної решітки). Сірководень з розчинів солей полонію в облогу чорний сульфід PoS.
Сильна радіоактивність полонію відбивається на властивостях його з'єднань. Так, в розведеної соляної кислоти полоній повільно розчиняється з утворенням рожевих розчинів (колір іонів Ро2 +):
Po + 2HCl ® PoCl2 + H2,
однак під дією власної радіації дихлорид перетворюється в жовтий PoCl4. Розбавлена азотна кислота пасивує полоній, а концентрована швидко його розчиняє:
Po + 8HNO3 → Po (NO3) 4 + 4NO2 + 4H2 O
З неметалами VI групи полоній ріднить реакція з воднем з утворенням летючого гідриду РоН2 (т.пл. -35 ° С, т.кіп. + 35 ° С, легко розкладається), реакція з металами (при нагріванні) з утворенням твердих полонідов чорного кольору (Na2 Po, MgPo, CaPo, ZnPo, HgPo, PtPo і ін.) і реакція з розплавленими лугами з утворенням полонідов:
3Po + 6NaOH ® 2Na2 Po + Na2 PoO3 + H2 O.
З хлором полоній реагує при нагріванні з утворенням яскраво-жовтих кристалів PoCl4, з бромом виходять червоні кристали PoBr4, з йодом вже при 40 ° С полоній реагує з утворенням чорного летючого йодиду PoI4. Відомий і білий тетрафторид полонію PoF4. При нагріванні тетрагалогеніди розкладаються з утворенням більш стабільних дигалогенідів:
PoCl4 ® PoCl2 + Cl2.
У розчинах полоній існує у вигляді катіонів Ро2 +, РО4 +, аніонів РоО32-, РоО42-, також різноманітних комплексних іонів, наприклад, PoCl62-.
Застосування полонію.Полоній-210 випускає альфа-промені з енергією 5,3 МеВ, які в твердій речовині гальмуються, проходячи всього тисячні частки міліметра і віддаючи при цьому свою енергію. Час його життя дозволяє використовувати полоній як джерело енергії в атомних батареях космічних кораблів: для отримання потужності 1 кВт достатньо всього 7,5 г полонію. В цьому відношенні він перевершує інші компактні «атомні» джерела енергії. Таке джерело енергії працював, наприклад, на «Місяцеході-2», обігріваючи апаратуру під час довгої місячної ночі. Звичайно, потужність полоніевих джерел енергії з часом зменшується - удвічі кожні 4,5 місяці, проте більш живучі ізотопи полонію занадто дорогі. Полоній зручно застосовувати і для дослідження впливу альфа-випромінювання на різні речовини. Як альфа-випромінювач, полоній в суміші з берилієм застосовують для виготовлення компактних джерел нейтронів:
9 Be + 4 He ® 12 C + n.
Замість берилію в таких джерелах можна використовувати бор. Повідомлялося, що в 2004 інспектори міжнародного агентства по атомної енергії(МАГАТЕ) виявили в Ірані програму з виробництва полонію. Це призвело до підозрою, що він може бути використаний в берилієвих джерелі для «запуску» за допомогою нейтронів ланцюгової ядерної реакції в урані, що приводить до ядерного вибуху.
Полоній при попаданні в організм можна вважати одним з найбільш отруйних речовин: для 210 Ро гранично допустимий вміст у повітрі становить усього 40 мільярдних часток мікрограма в 1 м3 повітря, тобто полоній в 4 трильйони разів більш токсична синильної кислоти. Шкоди завдають випускаються полонієм альфа-частинки (і в меншій мірі також гамма-промені), які руйнують тканини і викликають злоякісні пухлини. Атоми полонію можуть утворитися в легенях людини в результаті розпаду в них газоподібного радону. Крім того, металевий полоній здатний легко утворювати дрібні частки аерозолів. Тому всі роботи з полонієм проводять дистанційно в герметичних боксах.
Відкриття полонію.Існування елемента з порядковим номером 84 було передбачено Д.И.Менделєєвим в 1889 - він назвав його двителлура (на санскриті - «другий» телур) і припустив, що його атомна маса буде близька до 212. Звичайно, Менделєєв не міг передбачити, що цей елемент виявиться нестійким. Полоній - перший радіоактивний елемент, відкритий в 1898 подружжям Кюрі в пошуках джерела сильної радіоактивності деяких мінералів. Коли виявилося, що уранова смоляна руда випромінює сильніше, ніж чистий уран, Марія Кюрі вирішила виділити з цього з'єднання хімічним шляхомновий радіоактивний хімічний елемент. До цього було відомо тільки два слабо радіоактивних хімічних елемента - уран і торій. Кюрі почала з традиційного якісного хімічного аналізу мінералу за стандартною схемою, яка була запропонована німецьким хіміком-аналітиком К.Р.Фрезеніусом (1818-1897) ще в 1841 і по якій багато поколінь студентів протягом майже півтора століття визначали катіони так званим «сірководневим методом ». Спочатку у неї було близько 100 г мінералу; потім американські геологи подарували П'єру Кюрі ще 500 м Проводячи систематичний аналіз, М. Кюрі кожен раз перевіряла окремі фракції (опади і розчини) на радіоактивність за допомогою чутливого електрометрії, винайденого її чоловіком. Неактивні фракції відкидалися, активні аналізувалися далі. Їй допомагав один з керівників хімічного практикуму в Школі фізики і промислової хімії Густав Бемон.
Перш за все, Кюрі розчинила мінерал в азотній кислоті, випарити розчин насухо, залишок розчинила у воді і пропустила через розчин струм сірководню. При цьому випав осад сульфідів металів; відповідно до методики Фрезеніус, цей осад міг містити нерозчинні сульфіди свинцю, вісмуту, міді, миш'яку, сурми і ряду інших металів. Осад був радіоактивним, незважаючи на те, що уран і торій залишилися в розчині. Вона опрацювала чорний осад сульфідом амонію, щоб відокремити миш'як і сурму - вони в цих умовах утворюють розчинні тиосоли, наприклад, (NH4) 3 AsS4 і (NH4) 3 SbS3. Розчин не виявив радіоактивності і був відкинутий. В осаді залишилися сульфіди свинцю, вісмуту і міді.
Чи не розчинилася в сульфіді амонію частина осаду Кюрі знову розчинила в азотній кислоті, додала до розчину сірчану кислоту і випарувати його на полум'ї пальника до появи густих білих парів SO3. У цих умовах летюча азотна кислота повністю видаляється, а нітрати металів перетворюються в сульфати. Після охолодження суміші і додавання холодної води в осаді виявився нерозчинний сульфат свинцю PbSO4 - радіоактивності в ньому не було. Осад вона викинула, а до відфільтрувати розчину додала міцний розчин аміаку. При цьому знову випав осад, на цей раз - білого кольору; він містив суміш основного сульфату вісмуту (BiO) 2 SO4 і гідроксиду вісмуту Bi (OH) 3. У розчині же залишився комплексний аміакати міді SO4 яскраво-синього кольору. Білий осад, на відміну від розчину, виявився сильно радіоактивним. Оскільки свинець і мідь були вже відокремлені, в білому осаді був вісмут і домішка нового елемента.
Кюрі знову перевела білий осад в темно-коричневий сульфід Bi2 S3, висушила його і нагріла в вакуумированной ампулі. Сульфід вісмуту при цьому не змінився (він стійкий до нагрівання і лише при 685 ° С плавиться), однак з осаду виділилися якісь пари, які осіли у вигляді чорної плівки на холодній частині ампули. Плівка була радіоактивної і, очевидно, містила новий хімічний елемент - аналог вісмуту в періодичній таблиці. Це був полоній - перший після урану і торію відкритий радіоактивний елемент, вписаний в періодичну таблицю (в тому ж 1898 були відкриті радій, а також група благородних газів - неон, криптон і ксенон). Як потім з'ясувалося, полоній при нагріванні легко переганяється - його летючість приблизно така ж, як у цинку.
Подружжя Кюрі не поспішали назвати чорний наліт на склі новим елементом. Однією радіоактивності було мало. Колега і друг Кюрі французький хімік Ежен Анатоль Демарсе (1852-1903), фахівець в області спектрального аналізу (в 1901 році він відкрив европий), досліджував спектр випускання чорного нальоту і не виявив в ньому нових ліній, які могли б свідчити про присутність нового елемента. Спектральний аналіз - один з найбільш чутливих методів, що дозволяє виявляти багато речовин в мікроскопічних, невидимих оком кількостях. Проте, в статті, опублікованій 18 липня 1898 подружжя Кюрі написали: «Ми думаємо, що речовина, виділена нами з уранової смолки, містить не відомий поки метал, який є по аналітичними властивостями аналогом вісмуту. Якщо існування нового металу буде підтверджено, ми пропонуємо назвати його полонієм, за батьківщиною одного з нас »(Polonia на латині - Польща). Це єдиний випадок, коли ще не ідентифікований новий хімічний елемент вже отримав назву. Однак отримати вагові кількості полонію не вдалося - його в урановій руді було занадто мало (пізніше полоній був отриманий штучно). І прославив подружжя Кюрі не ця елемент, а радій.
Селен мало поширений в природі. У земній корі вміст селену становить. Його з'єднання зустрічаються у вигляді домішок до природних сполук сірки з металами і. Тому селен отримують з відходів, що утворюються при виробництві сірчаної кислоти, при електролітичному рафінуванні міді і при деяких інших процесах.Телур належить до числа рідкісних елементів: зміст його в земній корі становить всього.
У вільному стані селен, подібно сірці, утворює кілька аллотропических видозмін, з яких найбільш відомі аморфний селен, який представляє собою червоно-бурий порошок, і сірий селен, який утворює тендітні кристали з металевим блиском.
Телур теж відомий у вигляді аморфної модифікації і у вигляді кристалів світло-сірого кольору, що володіють металевим блиском.
Селен - типовий напівпровідник (див. § 190). Важливою властивістю його як напівпровідника є різке збільшення електричної провідності при освітленні. На кордоні селену з металевим провідником утворюється запірний шар - ділянку ланцюга, здатний пропускати електричний струм тільки в одному напрямку. У зв'язку з цими властивостями селен застосовується в напівпровідниковій техніці для виготовлення випрямлячів і фотоелементів з запірним шаром. Телур - теж напівпровідник, але його застосування більш обмежена. Селеніди і теллуріди деяких металів також володіють напівпровідниковими властивостями і застосовуються в електроніці. У невеликих кількостях телур служить легирующей добавкою до свинцю, покращуючи його механічні властивості.
Селеноводорода і теллуроводород представляють собою безбарвні гази з огидним запахом. Водні розчини їх є кислотами, константи дисоціації яких трохи більше, ніж константа дисоціації сірководню.
У хімічному відношенні селеноводорода і теллуроводород надзвичайно схожі на сірководень. Як і сірководень, вони в сильному ступені мають відновні властивості. При нагріванні обидва вони розкладаються. При цьому менш стійкий, ніж: подібно до того, як це відбувається в ряду галогеноводородов, міцність молекул зменшується при переході. Солі селеноводорода і теллуроводорода - селеніди і теллуріди - схожі з сульфідами щодо розчинності в воді і кислотах. Діючи на селеніди і теллуріди сильними кислотами, можна отримати селеноводорода і теллуроводород.
При спалюванні селену і телуру на повітрі або в кисні виходять діоксиди і, що знаходяться при звичайних умовах в твердому стані і є ангідридами селенистой і теллурістий кислот.
На відміну від діоксиду сірки, і виявляють переважно окислювальні властивості, легко відновлюючись до вільних селену і телуру, наприклад:
Дією сильних окислювачів діоксиди селену і телуру можуть бути переведені відповідно в селенову і телурової кислоти.
слайд 2
Сірка, селен і телур - це елементи головної підгрупи VI групи, члени сімейства халькогенов.
слайд 3
сірка
Сірка належить до числа речовин, відомих людству з давніх-давен. Ще стародавні греки і римляни знайшли їй різноманітне практичне застосування. Шматки самородної сірки використовувалися для здійснення обряду вигнання злих духів.
слайд 4
телур
В одній з областей Австрії, яка називалася СЕМИГОРЬЕ, в XVIII столітті була відкрита дивна руда блакитно білого кольору.
слайд 5
селен
Селен є одним з елементів, який людина знала ще до його офіційного відкриття. Цей хімічний елемент дуже добре маскувався іншими хімічними елементами, які за своїми характеристиками були схожі на селен. Основними елементами маскують його були сірка і телур.
слайд 6
отримання
Метод окислення сірководню до елементарної сірки був вперше розроблений в Великобританії, де значні кількості сірки навчилися отримувати з залишається після отримання соди Na2CO3 за методом французького хіміка Н. Леблана сульфіду кальцію CaS. Метод Леблана заснований на відновленні сульфату натрію вугіллям в присутності вапняку CaCO3. Na2SO4 + 2C = Na2S + 2CO2; Na2S + CaCO3 = Na2CO3 + CaS
слайд 7
Соду потім витравлюють водою, а водну суспензію погано розчинної сульфіду кальцію обробляють діоксидом вуглецю
CaS + CO2 + H2O = CaCO3 + H2S Утворений сірководень H2S в суміші з повітрям пропускають в печі над шаром каталізатора. При цьому за рахунок неповного окислення сірководню утворюється сірка 2H2S + O2 = 2H2O + 2S
слайд 8
Селенова кислота при нагріванні з соляною кислотою відновлюється до селенистой кислоти. Потім через отриманий розчин селенистой кислоти пропускають сірчистий газ SO2 H2SeO3 + 2SO2 + H2O = Se + 2H2SO4 Для очищення селен далі спалюють в кисні, насиченому парами димить азотної кислоти HNO3. При цьому сублімується чистий діоксид селену SeO2. З розчину SeO2в воді після додавання соляної кислоти селен знову осаджують, пропускаючи через розчин сірчистий газ.
слайд 9
Для виділення Te з шламів використовують їх спікання з содою з подальшим вилуговуванням. Ті переходить в лужний розчин, з якого при нейтралізації він осідає у вигляді TeO2 Na2TeO3 + 2HC = TeO2 + 2NaCl. Для очищення телуру від S і Se використовують його здатність під дією відновника (Al) в лужному середовищі переходити в розчинний дітеллуріддінатрія Na2Te2 6Te + 2Al + 8NaOH = 3Na2Te2 + 2Na.
слайд 10
Для осадження телуру через розчин пропускають повітря або кисень: 2Na2Te2 + 2H2O + O2 = 4Te + 4NaOH. Для отримання телуру особливої чистоти його хлорують: Te + 2Cl2 = TeCl4. Утворений тетрахлорид очищають дистиляції чи ректифікації. Потім тетрахлорідгідролізуют водою: TeCl4 + 2H2O = TeO2Ї + 4HCl, а що утворився ТеО2 відновлюють воднем: TeO2 + 4H2 = Te + 2H2O.
слайд 11
Фізичні властивості
слайд 12
Хімічні властивості
На повітрі сірка горить, утворюючи сірчистий ангідрид - безбарвний газ з різким запахом: S + O2 → SO2 Відновлювальні властивості сірки виявляються в реакціях сірки і з іншими неметалами, проте при кімнатній температурі сірка реагує тільки з фтором: S + 3F2 → SF6
слайд 13
Розплав сірки реагує з хлором, при цьому можливе утворення двох нижчих хлоридів 2S + Cl2 → S2Cl2 S + Cl2 → SCl2 При нагріванні сірка також реагує з фосфором, утворюючи суміш сульфідів фосфору, серед яких - вищий сульфід P2S5: 5S + 2P → P2S2 Крім того , при нагріванні сірка реагує з воднем, вуглецем, кремнієм: S + H2 → H2S (сірководень) C + 2S → CS2 (сірковуглець)
слайд 14
З складних речовин слід відзначити перш за все реакцію сірки з розплавленої лугом, в якій сірка диспропорционирует аналогічно хлору: 3S + 6KOH → K2SO3 + 2K2S + 3H2O З концентрованими кислотами-окислювачами сірка реагує тільки при тривалому нагріванні: S + 6HNO3 (конц) → H2SO4 + 6NO2 + 2H2O S + 2 H2SO4 (конц) → 3SO2 + 2H2O
слайд 15
При 100-160 ° C окислюється водою: Te + 2H2O = TeO2 + 2H2 При кип'ятінні в лужних розчинах телур диспропорционирует з утворенням телуриду і теллурита: 8Te + 6KOH = 2K2Te + K2TeO3 + 3H2O.
слайд 16
Розбавлена HNO3 окисляє Te до теллурістий кислоти H2TeO3: 3Te + 4HNO3 + H2O = 3H2TeO3 + 4NO. Сильні окислювачі (HClO3, KMnO4) окислюють Te до слабкої телурової кислоти H6TeO6: Te + HClO3 + 3H2O = HCl + H6TeO6. З'єднання телуру (+2) нестійкі і схильні до диспропорціонування: 2TeCl2 = TeCl4 + Te.
слайд 17
При нагріванні на повітрі згорає з утворенням безбарвного кристалічного SeO2: Se + O2 = SeO2. З водою взаємодіє при нагріванні: 3Se + 3H2O = 2H2Se + H2SeO3. Селен реагує при нагріванні з азотною кислотою, з утворенням селенистой кислоти H2SeO3: 3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO.
слайд 18
При кип'ятінні в лужних розчинах селен диспропорционирует: 3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O. Якщо селен кип'ятять в лужному розчині, через який пропускають повітря або кисень, то утворюються червоно-коричневі розчини, які містять поліселеніди: K2Se + 3Se = K2Se4
Селен і телур знаходяться в VI групи періодичної системи і є аналогами сірки. На зовнішньому електронному рівні у селену і телуру знаходяться по 6 електронів: Se 4s 2 4p 4; Te 5s 2 5p 4, тому вони виявляють ступеня окислення IV, VI і -II. Як і в будь-якій групі періодичної системи в міру зростання атомної маси елемента, кислотні властивості елемента слабшають, а основні зростають, тому у телуру проявляється цілий ряд основних (металевих властивостей) і не дивно, що першовідкривачі взяли його за метал.
Для селену характерний поліморфізм, існують 3 кристалічні і 2 аморфні модифікації.
склоподібний селен виходить швидким охолодженим розплавленого селену, складається з кільцевих молекул Se 8 і кілець до 1000 атомів.
Червоний аморфний селен утворюється, якщо швидко охолоджувати пари Se, в основному складається з неправильно орієнтованих молекул Se 8, він розчиняється в СS 2 при кристалізації отримують дві кристалічні модифікації:
t пл 170 0 С t пл 180 0 C
повільної швидкої
побудовані з молекул Se 8.
найбільш стійкий сірий гексагональний селен , Що складається з нескінченних ланцюгів атомів селену. При нагріванні всі модифікації переходять в останню. Це єдина напівпровідникова модифікація. Вона має: t пл 221 0 С і t кип 685 0 С. У парах поряд з Se 8 присутні і молекули з меншим числом атомів аж до Se 2.
У теллура все більш просто - найбільш стійкий гексагональний телур, з t пл 452 0 С і t кип 993 0 С. Аморфний телур - це дрібнодисперсний гексагональний телур.
Селен і телур стійкі на повітрі, при нагріванні горять, утворюючи діоксиди SeO 2 і TeO 2. При кімнатній температурі не реагують з водою.
При нагріванні аморфного селену до t 60 0 С, починає реагувати з водою:
3Se + 3Н 2 О = 2Н 2 Se + Н 2 SEО 3 (17)
Teллур менш активний і реагує з водою вище 100 0 С. З лугами реагують при більш м'яких умовах, утворюючи:
3Se + 6NaOH = 2Na 2 Se + Na 2 SeO 3 + 3H 2 O (18)
3Te + 6NaOH = 2Na 2 Te + Na 2 TeO 3 + 3H 2 O (19)
C кислотами (НСl і розбавлені H 2 SO 4) не реагують, розбавлена HNO 3 окисляє їх до H 2 SeO 3; H 2 TeO 3, якщо кислота концентрована, то вона окисляє телур до основного нітрату Te 2 O 3 (OH) NO 3.
Концентрована H 2 SO 4 розчиняє селен і телур, утворюючи
Se 8 (HSO 4) 2 - зелені H 2 SeO 3
Te 4 (HSO 4) 2 - червоні Te 2 O 3 SO 4
½ розчини
малостійкі
виділяються Se і Te
Для Se як і для S характерні реакції приєднання:
Na 2 S + 4Se = Na 2 SSe 4 (найбільш стійкі) (20)
Na 2 S + 2Тe = Na 2 SТe 2 (найбільш стійкі) (21)
в загальному випадку Na 2 SЕ n, де Е = Se, Te.
Na 2 SO 3 + Se Na 2 SeSO 3 (22)
селеносульфату
Для теллура така реакція відбувається тільки в автоклавах.
Se + KCN = KSeCN (для телуру невідома) (23)
З воднем селен взаємодіє при температурі 200 0 С:
Se + H 2 = H 2 Se (24)
Для теллура реакція протікає важко і вихід теллуроводорода малий.
Селен і телур взаємодіють з більшістю металів. У з'єднаннях для селену і телуру характерні ступені окислення -2, +4, відомі і +6.
З'єднання з кіслородом.Діоксіди. SeO 2 - білий, t возг. - 337 0 С, розчиняється в воді, утворюючи H 2 SeO 3 - нестійка, при температурі 72 0 С розкладається по перетектіческой реакції.
Тео 2 - більш тугоплавок, t пл. - 733 0 С, t кип. - 1260 0 С, не леткий, мало розчинний у воді, легко розчиняється в лугах, мінімум розчинності доводиться на рН ~ 4, з розчину виділяється осад H 2 TeO 3, нестійка і при висушуванні розпадається.
Триоксиди.Вищі оксиди виходять при дії сильних окислювачів.
SeO 3 (нагадує SO 3) реагує з водою, утворюючи H 2 SeO 4, t пл. ~ 60 0 С, сильний окислювач, розчиняє Au:
2Au + 6H 2 SeO 4 = Au 2 (SeO 4) 3 + 3H 2 SeO 3 + 3H 2 O (25)
в суміші з НCl розчиняє Pt.
ТeO 3 - малоактивне речовина, існує в аморфній і кристалічної модифікаціях. Аморфний триоксид при тривалому впливі гарячої води гідратіруется, переходячи в орто-телурової кислоту H 6 TeO 6. Розчиняється в концентрованих розчинах лугів при нагріванні, утворюючи теллуратов.
H 2 TeO 4 має три різновиди: орто-телурової кислота H 6 TeO 6 добре розчинна в H 2 O, її розчини не дають кислу реакцію, дуже слабка кислота, при зневодненні виходить поліметателлуровая кислота (H 2 TeO 4) n нерозчинна у воді. Аллотеллуровая кислота виходить нагріванням орто-телурової кислоти в запаяній ампулі, змішується з водою в будь-яких відносинах і має кислий характер. Є проміжною, в ланцюзі 6 - 10 молекул, нестійка, при кімнатній температурі переходить в орто-телурової кислоту, а при нагріванні на повітрі швидко перетворюється в H 2 TeO 4.
Солі.Для селенатов солі важких металів добре розчиняються у воді, мало розчинні селенатов ЛЗМ, свинцю і на відміну від сульфатів, Ag і Tl. При нагріванні утворюють селеніти (відміну від сульфатів). Селеніти більш стійкі, ніж сульфіти, їх можна розплавити на відміну від сульфітів.
Теллуратов Na 2 H 4 TeO 6 - ортотеллурат існує в двох модифікаціях, отриманий при низьких температурах, розчинний у воді, при високих - не розчинний. При зневодненні виходить Na 2 TeO 4 не розчинний у воді. Малою розчинністю відрізняються теллуратов важких і ЛЗМ. На відміну від теллуратов, телурит натрію розчинний у воді.
Гідриди.Н 2 Se і Н 2 Т e гази, розчиняються у воді і дають більш сильні кислоти, ніж H 2 S. При нейтралізації лугами утворюють солі, аналогічні Na 2 S. Для теллуридов і селенидов, як і для Na 2 S, характерні реакції приєднання:
Na 2 Se + Se = Na 2 Se 2 (26)
Na 2 Se + nS = Na 2 SeS n (27)
У загальному випадку утворюються Na 2 ЕS 3 і Na 2 ЕS 4, де Е - селен і телур.
Хлориди.Якщо для сірки найбільш стійкий S 2 Cl 2, то для селену подібне з'єднання відомо, однак найбільш стійкий SeCl 4, для телуру ТeCl 4. При розчиненні в воді SeCl 4 гидролизируется:
SeCl 4 + 3H 2 O = 4НCl + H 2 SeO 3 (28)
ТeCl 4 розчиняється без помітного гідролізу.
Для ТeCl 4 відомі комплекси: K 2 TeCl 6 і KTeCl 5, з хлоридом алюмінію утворює катіонні комплекси + -. У деяких випадках утворює комплекси і селен, але для нього відомі лише гексахлорселенати: M 2 SeCl 6.
При нагріванні возгоняются і диссоциируют:
SeCl 4 = SeCl 2 + Cl 2 (29)
при конденсації диспропорционируют:
2ТeCl 2 = Ті + TeCl 4 (30)
Відомі фториди, броміди, йодиди утворюються тільки у телуру.
Сульфіди.При сплаві з сіркою з'єднань не утворюється. При дії H 2 S на солі селену і телуру можна осадити TeS 2 і суміш SeS 2 і SeS (вважають, що це суміш S і Se).
Синтезом, шляхом заміщення в молекулі S 8 сірки на селен, отримані Se 4 S 4, Se 3 S 5, Se 2 S 6, SeS 7, заміщення відбувається через один атом сірки.