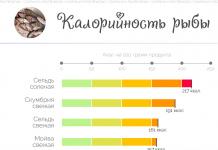
Розкладання перекису водню під дією каталізатора і в присутності рідкого мила- один з найкрасивіших хімічних дослідів. У російськомовній літературі даний експеримент не має специфічного назви, в англомовних джерелах його називають Elephant "s Toothpaste, що у вільному перекладі звучить як Зубна паста для слона.
Для експерименту потрібна 30-50% перекис водню (пергідроль), трохи рідкого миючого засобу (яке дає багато стійкої піни) і каталізатор розкладання перекису водню. При контакті перекису з каталізатором відбувається активне виділення кисню, а завдяки присутності рідкого мила утворюється багато піни (протягом короткого часу). У суміш нерідко додають барвники, які забарвлюють піну в різні кольори. Потік піни, який виривається з отвору колби або циліндра, часто дійсно нагадує " зубну пастудля слона ".
В якості каталізатора розкладання перекису водню можна використовувати різні речовини і суміші, наприклад: аміакати міді, йодид калію і навіть суспензію дріжджів.
У минулому я вже проводив цей експеримент, але подивитися в свої старі записи не спромігся, в результаті перший досвід не вийшов. Я взяв 7.5 г мідного купоросу, додав до нього 30 мл концентрованого розчину аміаку, ретельно перемішав. Розчин перелив в літрову колбу, додав 50 мл рідкого миючого засобу для посуду Gala і 80 мл дистиляту, знову перемішав. У колбу налив 100 мл пергідролю, взятого з холодильника. Вірніше, спробував налити: почалася бурхлива реакція, в результаті я не встиг додати приблизно 1/3 пергідролю. Бурхливий розкладання перекису мало місце, але експеримент вийшов огидно: піни було мало.
Тоді я подивився старі записи. Виявилося, що в минулий раз я взяв зовсім інші кількості речовин:
"У конічну колбу на 300 мл налийте 10-20 мл рідкого миючого засобу для посуду Gala (або будь-якого аналогічного миючого засобу). В іншій колбі розчиніть 3-4 гр сульфату міді в надлишку міцного розчину аміаку (додавайте аміак, поки сульфат міді повністю не розчиниться). Утворюється синій аміакати міді (II):
CuSO 4 + 6NH 3 + 2H 2 O = (OH) 2 + (NH 4) 2 SO 4
Вилийте розчин аміакати міді в колбу з миючим засобом і добре перемішайте. Поставте колбу на стіл і швидко додайте в неї 50-100 мл 30-50% розчину перекису водню. Відбудеться сильне виділення газу. З колби вдарить фонтан піни. Весь простір навколо колби за кілька секунд заповниться великим грудкою піни. Від піни буде підніматися пар - реакція розкладання перекису водню протікає з виділенням тепла. У наших експериментах висота і ширина утворилася піни була близько 60 см. "
Іншими словами, аміакати міді і рідкого мила потрібно було брати менше.
Для другого досліду взяв конічну колбу на 300 мл, 2 г мідного купоросу, до яких додав 20 концентрованого розчину аміаку. Після розчинення сульфату міді додав 20 мл рідкого миючого засобу для посуду Gala, перемішав. Взяв 70 мл перекису водню, але встиг додати тільки 50 мл - почалося активне утворення піни.
Піна, що виходила з колби, дійсно нагадувала зубну пасту, яка видавлювати з тюбика. Завдяки аміакати міді уздовж піни простяглися пофарбовані в синій колір смуги. Досвід вийшов непогано, але розкладання проходило повільно і зайняло більше 2.5 хвилин.
Згадав, що проводив досвід, описаний в статті
Мета і завдання 1.Ціль: З'ясувати, які продукти, містять каталізатор и, що прискорюють розкладання пероксиду водню, а які ні. 2. Завдання: o Дізнатися що таке каталізатор o Провести досвід з пероксидом водню і дізнатися які продукти є каталізатором. 1.Ціль: З'ясувати, які продукти, містять каталізатор и, що прискорюють розкладання пероксиду водню, а які ні. 2. Завдання: o Дізнатися що таке каталізатор o Провести досвід з пероксидом водню і дізнатися які продукти є каталізатором.


Які продукти є каталізаторами? 1. Ми взяли гематоген, капнули пероксиду водню і побачили, що виділяється кисень, отже. пероксид водню розкладається. 2. Ми, також взяли і інші продукти, наприклад, сире м'ясо, сира картопля, буряк, хліб, часник, банан, какао і з'ясували, що вони такж е містять каталізатор и.


Висновок У ході роботи ми з'ясували, що продуктами, що містять каталізатор и розкладання пероксиду водню є: гематоген, сире м'ясо, сира картопля, буряк, хліб, часник, банан, какао. Ними не є: яблуко, заварка, печиво, апельсин / мандарин, ковбаса, копчене м'ясо, кетчуп, мед, шоколадна цукерка. Так само ми дізналися що таке каталізатор і як проводити цей досвід.

Багато дослідників 19 в., Які одержували чистий пероксид водню, відзначали небезпеку цього з'єднання. Так, коли намагалися відокремити Н
2 Про 2 від води шляхом екстракції з розбавлених розчинів діетиловим ефіром з подальшою відгоном летючого ефіру, отримана речовина іноді без видимих причин вибухало. В одному з таких дослідів німецький хімік Ю.В.Брюль отримав безводний Н 2 Про 2 , Який мав запахом озону і вибухнув від дотику неоплавленной скляної палички. Незважаючи на малі кількості Н 2 Про 2 (Всього 1 2 мл) вибух був такої сили, що пробив круглу дірку в дошці столу, зруйнував вміст його ящика, а також стоять на столі і поблизу склянки і прилади.Фізичні властивості. Чистий пероксид водню дуже сильно відрізняється від знайомого всім 3% -ного розчину Н 2 Про 2 , Який стоїть в домашній аптечці. Перш за все, він майже в півтора рази важча за воду (щільність при 20 ° С дорівнює 1,45 г / см 3). Замерзає Н 2 О 2 при температурою трохи меншою, ніж температура замерзання води при мінус 0,41 ° С, але якщо швидко охолодити чисту рідину, вона зазвичай не замерзає, а переохолоджується, перетворюючись в прозору стеклообразную масу. розчини Н 2 Про 2 замерзають при значно нижчій температурі: 30% -ний розчин при мінус 30 ° С, а 60% -ний при мінус 53 ° С. Кипить Н 2 Про 2 при температурі вищій, ніж звичайна вода, При 150,2 ° С. Змочує скло Н 2 Про 2 гірше, ніж вода, і це призводить до цікавого явища при повільній перегонці водних розчинів: поки з розчину відганяється вода, вона, як завжди, надходить з холодильника в приймач у вигляді крапель; коли ж починає переганяти Н 2 Про 2 , Рідина виходить з холодильника у вигляді безперервної тоненькою цівки. На шкірі чистий пероксид водню і його концентровані розчини залишають білі плями і викликають відчуття пекучого болю через сильний хімічного опіку.У статті, присвяченій отриманню пероксиду водню, Тенар не дуже вдало порівняв цю речовину з сиропом, можливо, він мав на увазі, що чистий Н
2 Про 2 , Як і цукровий сироп, Сильно заломлює світло. Дійсно, коефіцієнт заломлення безводного Н 2 Про 2 (1,41) набагато більше, ніж у води (1,33). Однак чи то в результаті невірного тлумачення, чи то через погане перекладу з французької, практично у всіх підручниках досі пишуть, що чистий пероксид водню «густа сиропообразная рідина», і навіть пояснюють це теоретично освітою водневих зв'язків. Але ж вода теж утворює водневі зв'язки. Насправді в'язкість у Н 2 Про 2 така ж, як і у трохи охолодженої (приблизно до 13 ° С) води, але не можна сказати, що прохолодна вода густа, як сироп.Реакція розкладання. Чистий пероксид водню речовина дуже небезпечне, так як при деяких умовах можливо його вибуховий розкладання: Н 2 О 2 ® Н 2 О + 1/2 О2 з виділенням 98 кДж на моль Н 2 Про 2 (34 г). Це дуже велика енергія: вона більше, ніж та, яка виділяється при утворенні 1 благаючи HCl при вибуху суміші водню і хлору; її досить, щоб повністю випарувати в 2,5 рази більше води, ніж утворюється в цій реакції. Небезпечні і концентровані водні розчини Н 2 Про 2 , В їх присутності легко самовоспламеняются багато органічні сполуки, а при ударі такі суміші можуть вибухати. Для зберігання концентрованих розчинів використовують судини з особливо чистого алюмінію або парафіновані скляні посудини.Найчастіше доводиться зустрічатися з менш концентрованим 30% -ним розчином Н
2 Про 2 , Який називається пергідролем, але і такий розчин небезпечний: викликає опіки на шкірі (при його дії шкіра відразу ж біліє через знебарвлення барвників), при попаданні домішок можливо вибуховий закипання. розкладання Н 2 Про 2 і його розчинів, в тому числі і вибуховий, викликають багато речовин, наприклад, іони важких металів, які при цьому відіграють роль каталізатора, і навіть порошинки. 2 Про 2 пояснюються сильною зекзотермічностью реакції, ланцюговим характером процесу і значним зниженням енергії активації розкладання Н 2 Про 2 в присутності різних речовин, про що можна судити за наступними даними:Фермент каталаза міститься в крові; саме завдяки їй «закипає» від виділення кисню аптечна «перекис водню», коли її використовують для дезінфекції порізаного пальця. Реакцію розкладання концентрованого розчину Н 2 Про 2 під дією каталази використовує не тільки людина; саме ця реакція допомагає жука-бомбардира боротися з ворогами, випускаючи в них гарячий струмінь ( см . ВИБУХОВІ РЕЧОВИНИ). Інший фермент пероксидаза діє інакше: він не розкладає Н 2 Про 2 , Але в його присутності відбувається окислення інших речовин пероксидом водню.Ферменти, що впливають на реакції пероксиду водню, відіграють велику роль в життєдіяльності клітини. Енергію організму постачають реакції окислення за участю надходить з легких кисню. У цих реакціях проміжно утворюється Н
2 Про 2 , Який шкідливий для клітини, так як викликає необоротне ушкодження різних біомолекул. Каталаза і пероксидаза спільно перетворюють Н 2 Про 2 в воду і кисень.Реакція розкладання Н
2 Про 2 часто протікає по радикально-ланцюговому механізму ( см. ЛАНЦЮГОВІ РЕАКЦІЇ), При цьому роль каталізатора полягає в ініціюванні вільних радикалів. Так, в суміші водних розчинів Н 2 О 2 і Fe 2+ (Так званий реактив Фентона) йде реакція переносу електрона з іона Fe 2+ на молекулу H 2 O 2 з утворенням іона Fe 3+ і дуже нестійкого аніон-радикала . , Який відразу ж розпадається на аніон ВІН і вільний гідроксильний радикал ОН. ( см. ВІЛЬНІ радикали). радикал ОН. дуже активний. Якщо в системі є органічні сполуки, то можливі їх різноманітні реакції з гідроксильними радикалами. Так, ароматичні з'єднання і оксикислоти окислюються (бензол, наприклад, перетворюється в фенол), ненасичені сполуки можуть приєднати гідроксильні групи по подвійному зв'язку: СН 2 = СН СН 2 ОН + 2ОН. ® носно 2 СН (ОН) СН 2 ВІН, а можуть вступити в реакцію полімеризації. За відсутності ж відповідних реагентів ОН. реагує з Н 2 О 2 з утворенням менш активного радикала НО 2 . , Який здатний відновлювати іони Fe 2+ , Що замикає каталітичний цикл: H 2 O 2 + Fe 2+ ® Fe 3+ + OH . + OH ОН. + Н 2 О 2 ® H 2 O + HO 2 .HO 2 . + Fe 3+
® Fe 2+ + O 2 + H + ® H 2 O. При певних умовах можливе ланцюгове розкладання Н 2 Про 2 , Спрощений механізм якого можна представити схемою. + Н 2 О 2 ® H 2 O + HO 2 . 2 . + H 2 O 2® H 2 O + O 2 + OH . і т.д.Реакції розкладання Н
2 Про 2 йдуть в присутності різних металів змінної валентності. Пов'язані в комплексні сполуки, вони часто значно посилюють свою активність. Наприклад, іони міді менш активні, ніж іони заліза, але пов'язані в аміачні комплекси 2+ , Вони викликають швидке розкладання Н 2 Про 2 . Аналогічну дію надають іони Mn 2+ пов'язані в комплекси з деякими органічними сполуками. У присутності цих іонів вдалося виміряти довжину ланцюга реакції. Для цього спочатку виміряли швидкість реакції по швидкості виділення з розчину кисню. Потім в розчин ввели в дуже малій концентрації (близько 10 5 моль / л) інгібітор речовина, ефективно реагує з вільними радикалами і обривають таким чином ланцюг. Виділення кисню відразу ж припинилося, але приблизно через 10 хвилин, коли весь інгібітор витратився, знову відновилося з колишньою швидкістю. Знаючи швидкість реакції і швидкість обриву ланцюгів, неважко розрахувати довжину ланцюга, яка виявилася рівною 10 3 ланок. Велика довжина ланцюга обумовлює високу ефективність розкладання Н 2 Про 2 в присутності найбільш ефективних каталізаторів, які з високою швидкістю генерують вільні радикали. При зазначеної довжині ланцюга швидкість розкладання Н 2 Про 2 фактично збільшується в тисячу разів.Іноді помітне розкладання Н
2 Про 2 викликають навіть сліди домішок, які майже не виявляються аналітично. Так, одним з найефективніших каталізаторів виявився золь металевого осмію: сильне каталітична дія його спостерігалося навіть при розведенні 1:10 9 , Тобто 1 г Os на 1000 т води. Активними каталізаторами є колоїдні розчини паладію, платини, іридію, золота, срібла, а також тверді оксиди деяких металів MnO 2, Co 2 O 3, PbO 2 та ін., які самі при цьому не змінюються. Розкладання може йти дуже бурхливо. Так, якщо маленьку щіпку MnO 2 кинути в пробірку з 30% -ним розчином Н 2 Про 2 , З пробірки виривається стовп пари з бризками рідини. З більш концентрованими розчинами відбувається вибух. Більш спокійно протікає розкладання на поверхні платини. При цьому на швидкість реакції сильно впливає стан поверхні. Німецький хімік Вальтер Шпрінг провів в кінці 19 ст. такий досвід. У ретельно очищеної і відполірованою платиновій чашці реакція розкладання 38% -ного розчину Н 2 Про 2 не йшлося навіть при нагріванні до 60 ° С. Якщо ж зробити голкою на дні чашки ледве помітну подряпину, то вже холодний (при 12 ° С) розчин починає виділяти на місці подряпини бульбашки кисню, а при нагріванні розкладання уздовж цього місця помітно посилюється. Якщо ж в такий розчин ввести губчасту платину, що володіє дуже великою поверхнею, то можливо вибуховий розкладання.Швидке розкладання Н
2 Про 2 можна використовувати для ефектного лекційного досвіду, якщо до внесення каталізатора додати до розчину поверхнево-активна речовина (мило, шампунь). Вирізняється кисень створює рясну білу піну, яку назвали «зубною пастою для слона».Деякі каталізатори ініціюють нецепное розкладання Н
2 О 2, наприклад: H 2 O 2 + 2I + 2H + ® 2H 2 O + I 2 ® 2I + 2H + + O 2. Нецепная реакція йде і в разі окислення іонів Fe 2+ в кислих розчинах: 2FeSO 4 + H 2 O 2 + H 2 SO 4 ® Fe 2 (SO 4) 3 + 2H 2 O. Оскільки у водних розчинах майже завжди є сліди різних каталізаторів (каталізувати розкладання можуть і іони металів, що містяться в склі), до розчинів Н 2 Про 2 , Навіть розведеним, при їх тривалому зберіганні додають інгібітори і стабілізатори, що зв'язують іони металів. При цьому розчини злегка підкисляють, так як при дії чистої води на скло виходить слаболужній розчин, що сприяє розкладанню Н 2 О 2. Всі ці особливості розкладання Н 2 Про 2 дозволяють вирішити протиріччя. Для отримання чистого Н 2 Про 2 необхідно проводити перегонку при зниженому тиску, оскільки речовина розкладається при нагріванні вище 70 ° С і навіть, хоча дуже повільно, при кімнатній температурі (як сказано в Хімічної енциклопедії, зі швидкістю 0,5% на рік). У такому випадку, як же отримана фігурує в тій же енциклопедії температура кипіння при атмосферному тиску, що дорівнює 150,2 ° С? Зазвичай в таких випадках використовують фізико-хімічну закономірність: логарифм тиску пари рідини лінійно залежить від зворотної температури (за шкалою Кельвіна), тому якщо точно виміряти тиск пара Н 2 Про 2 при декількох (невисоких) температурах, то легко можна розрахувати, при якій температурі це тиск досягне 760 мм рт.ст. А це і є температура кипіння при звичайних умовах.Теоретично радикали ОН
. можуть утворитися і під час відсутності ініціаторів, в результаті розриву слабшої зв'язку О О, але для цього потрібна досить висока температура. Незважаючи на відносно невелику енергію розриву зв'язку з цим в молекулі Н 2 Про 2 (Вона дорівнює 214 кДж / моль, що в 2,3 рази менше, ніж для зв'язку Н ОН в молекулі води), зв'язок Про Про все ж досить міцна, щоб пероксид водню був абсолютно стійкий при кімнатній температурі. І навіть при температурі кипіння (150 ° С) він повинен розкладатися дуже повільно. Розрахунок показує, що прицій температурі розкладання на 0,5% повинно відбуватися теж досить повільно, навіть якщо довжина ланцюга дорівнює 1000 ланок. Невідповідність розрахунків і досвідчених даних пояснюється каталітичним розкладанням, викликаним і найдрібнішими домішками в рідини і стінками реакційної посудини. Тому виміряна багатьма авторами енергія активації розкладання Н 2 Про 2 завжди значно менше, ніж 214 кДж / моль навіть «за відсутності каталізатора». Насправді каталізатор розкладання завжди є і у вигляді незначних домішок в розчині, і у вигляді стінок посудини, саме тому нагрівання безводного Н 2 Про 2 до кипіння при атмосферному тиску неодноразово викликало вибухи.У деяких умовах розкладання Н
2 Про 2 відбувається дуже незвично, наприклад, якщо нагріти підкислений сірчаною кислотою розчин Н 2 Про 2 в присутності иодата калію KIO 3 , То при певних концентраціях реагентів спостерігається коливальна реакція, при цьому виділення кисню періодично припиняється, а потім поновлюється з періодом від 40 до 800 секунд.Хімічні властивості Н 2 О 2. Пероксид водню кислота, але дуже слабка. Константа дисоціації H 2 O 2 H + + HO 2 при 25 ° С дорівнює 2,4 · 10 12 , Що на 5 порядків менше, ніж для H 2 S. Середні солі Н 2 О 2 лужних і лужноземельних металів зазвичай називають пероксидамі ( см. ПЕРОКСИДИ). При розчиненні в воді вони майже повністю гідролізуються: Na 2 O 2 + 2H 2 O ® 2NaOH + H 2 O 2 . Гідролізу сприяє підкислення розчинів. Як кислота Н 2 Про 2 утворює і кислі солі, наприклад, Ва (АЛЕ 2) 2, NaHO 2 та ін. Кислі солі менш схильні до гідролізу, але легко розкладаються при нагріванні з виділенням кисню: 2NaHO 2 ® 2NaOH + O 2 . Виділяється луг, як і в разі Н 2 Про 2 , Сприяє розкладанню.розчини Н
2 Про 2 , Особливо концентровані, володіють сильним окислювальним дією. Так, при дії 65% -ного розчину Н 2 Про 2 на папір, тирса та інші горючі речовини вони спалахують. Менш концентровані розчини знебарвлюють багато органічні сполуки, наприклад, індиго. Незвично йде окислення формальдегіду: Н 2 Про 2 відновлюється не до води (як завжди), а до вільного водню: 2НСНО + Н 2 О 2 ® 2НСООН + Н 2 . Якщо взяти 30% -ний розчин Н 2 Про 2 і 40% -ний розчин НСНО, то після невеликого підігріву починається бурхлива реакція, рідина закипає і піниться. Окислювальне дію розбавлених розчинів Н 2 Про 2 найбільше проявляється в кислому середовищі, наприклад, H 2 O 2 + H 2 C 2 O 4 ® 2H 2 O + 2CO 2 , Але можливо окислення і в лужному середовищі:Na + H 2 O 2 + NaOH® Na 2; 2K 3 + 3H 2 O 2® 2KCrO 4 + 2KOH + 8H 2 O. Окислення чорного сульфіду свинцю до білого сульфату PbS+ 4H 2 O 2 ® PbSO 4 + 4H 2 O можна використовувати для відновлення потемнілих свинцевих білил на старих картинах. Під дією світла йде окислення і соляної кислоти: H 2 O 2 + 2HCl ® 2H 2 O + Cl 2. Додавання Н 2 О 2 до кислот сильно збільшує їх дію на метали. Так, в суміші H 2 O 2 і розведеної H 2 SO 4 розчиняються мідь, срібло і ртуть; йод в кислому середовищі окислюється до иодной кислоти HIO 3 , Сірчистий газ до сірчаної кислоти і т.д.Незвично відбувається окислення калій-натрієвої солі винної кислоти (сегнетової солі) в присутності хлориду кобальту в якості каталізатора. В ході реакції KOOC (CHOH)
2 COONa + 5H 2 O 2 ® KHCO 3 + NaHCO 3 + 6H 2 O + 2CO 2рожевий CoCl 2 змінює колір на зелений через утворення комплексної сполуки з тартратом аніоном винної кислоти. У міру протікання реакції і окислення тартрату комплекс руйнується і каталізатор знову рожевіє. Якщо замість хлориду кобальту використовувати в якості каталізатора мідний купорос, то проміжне з'єднання, в залежності від співвідношення вихідних реагентів, буде забарвлено в помаранчевий або зелений колір. Після закінчення реакції відновлюється синій колір мідного купоросу.Зовсім інакше реагує пероксид водню в присутності сильних окислювачів, а також речовин, легко віддають кисень. У таких випадках Н
2 Про 2 може виступати і як відновник з одночасним виділенням кисню (так званий відновний розпад Н 2 О 2), наприклад: 2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4® K 2 SO 4 + 2MnSO 4 + 5O 2 + 8H 2 O;Ag 2 O + H 2 O 2
® 2Ag + H 2 O + O 2; О 3 + Н 2 О 2 ® H 2 O + 2O 2; ® NaCl + H 2 O + O 2. Остання реакція цікава тим, що в ній утворюються порушені молекули кисню, які випускають помаранчеву флуоресценцию ( см. ХЛОР АКТИВНИЙ). Аналогічно з розчинів солей золота виділяється металеве золото, з оксиду ртуті виходить металева ртуть і т.д. Таке незвичайне властивість Н 2 Про 2 дозволяє, наприклад, провести окислення гексаціаноферрата (II) калію, а потім, змінивши умови, відновити продукт реакції в вихідне з'єднання за допомогою того ж реактиву. Перша реакція йде в кислому середовищі, друга в лужному:2K 4 + H 2 O 2 + H 2 SO 4® 2K 3 + K 2 SO 4 + 2H 2 O;2K 3 + H 2 O 2 + 2KOH
® 2K 4 + 2H 2 O + O 2.( «Подвійний характер» Н 2 Про 2 дозволив одному викладачеві хімії порівняти пероксид водню з героєм повісті відомого англійського письменника Стівенсона Дивна історія доктора Джекіла і містера Хайда, Під впливом придуманого ним складу він міг різко змінювати свій характер, перетворюючись з добропорядного джентльмена в кровожерного маніяка.)Отримання Н 2 О 2.Молекули Н 2 О 2 завжди виходять в невеликих кількостях при горінні і окисленні різних з'єднань. При горінні Н 2 Про 2 утворюється або при відриві атомів водню від вихідних сполук проміжними гідропероксіднимі радикалами, наприклад: HO 2 . + CH 4 ® H 2 O 2 + CH 3 . , Або в результаті рекомбінації активних вільних радикалів: 2ОН. ® Н 2 О 2, Н. + АЛЕ 2 . ® Н 2 О 2 . Наприклад, якщо киснево-водневе полум'я направити на шматок льоду, то растаявшая вода буде містити в помітних кількостях Н 2 Про 2 , Що утворився в результаті рекомбінації вільних радикалів (в полум'я молекули Н 2 Про 2 негайно розпадаються). Аналогічний результат виходить і при горінні інших газів. Освіта Н 2 Про 2 може відбуватися і при невисокій температурі в результаті різних окислювально-відновних процесів.У промисловості пероксид водню вже давно не отримують способом Тенара з пероксиду барію, а використовують більш сучасні методи. Один з них електроліз розчинів сірчаної кислоти. При цьому на аноді сульфат-іони окислюються до надсульфат-іонів: 2SO
4 2 2e ® S 2 O 8 2 . Надсерная кислота потім гідролізується: H 2 S 2 O 8 + 2H 2 O ® H 2 O 2 + 2H 2 SO 4. На катоді, як зазвичай, йде виділення водню, так що сумарна реакція описується рівнянням 2H 2 O ® H 2 O 2 + H 2 . Але основний сучасний спосіб (понад 80% світового виробництва) окислення деяких органічних сполук, наприклад, етілантрагідрохінона, киснем повітря в органічному розчиннику, при цьому з антрагідрохінона утворюються Н 2 Про 2 і відповідний Антрахінон, який потім знову відновлюють воднем на каталізаторі в антрагідрохінон. Пероксид водню беруть із суміші водою і концентрують перегонкою. Аналогічна реакція протікає і при використанні ізопропілового спирту (вона йде з проміжним утворенням гідропероксиду): (СН 3) 2 СНОН + О 2 ® (СН 3) 2 С (ООН) ОН ® (СН 3) 2 СО + Н 2 О 2 . При необхідності утворився ацетон також можна відновити до ізопропілового спирту.Застосування Н 2 О 2. Пероксид водню знаходить широке застосування, а його світове виробництво обчислюється сотнями тисяч тонн на рік. Його використовують для отримання неорганічних пероксидов, як окислювач ракетного палива, в органічних синтезах, для відбілювання олій, жирів, тканин, паперу, для очищення напівпровідникових матеріалів, для вилучення з руд цінних металів (наприклад, урану шляхом перекладу його нерозчинної форми в розчинну), для знешкодження стічних вод. У медицині розчини Н 2 Про 2 застосовують для полоскання і змазування при запальних захворюванняхслизових оболонок (стоматити, ангіна), для лікування гнійних ран. В пеналах для зберігання контактних лінз в кришку іноді поміщають дуже невелика кількість платинового каталізатора. Лінзи для їх дезінфекції заливають в пеналі 3% -ним розчином Н 2 Про 2 , Але так як цей розчин шкідливий для очей, пенал через деякий час перевертають. При цьому каталізатор в кришці швидко розкладає Н 2 Про 2 на чисту воду і кисень.Колись модно було знебарвлювати волосся «перекисом», зараз для такої процедури існують більш безпечні склади.
У присутності деяких солей пероксид водню утворює як би твердий «концентрат», який зручніше перевозити і використовувати. Так, якщо до сильно охолодженого насиченого розчину борнокіслого натрію (бура) додати Н
2 Про 2 в присутності, поступово утворюються великі прозорі кристали пероксоборати натрію Na 2 [(BO 2) 2 (OH) 4 ]. Ця речовина широко використовується для відбілювання тканин і як компонент миючих засобів. молекули Н 2 Про 2 , Як і молекули води, здатні впроваджуватися в кристалічну структуру солей, утворюючи подобу кристаллогидратов пероксогідрати, наприклад, К 2 СО 3 · 3Н 2 О 2, Na 2 CO 3 · 1,5H 2 O; Останнім з'єднання широко відоме під назвою «персоль».Так званий «гидроперит» CO (NH
2) 2 · H 2 O 2 є клатрат з'єднання включення молекул Н 2 Про 2 в порожнечі кристалічної решітки сечовини.В аналітичній хімії за допомогою пероксиду водню можна визначати деякі метали. Наприклад, якщо до розчину солі титану (IV) сульфату титанів додати пероксид водню, розчин набуває яскраво-оранжевий колір внаслідок утворення надтитанові кислоти:
TiOSO 4 + H 2 SO 4 + H 2 O 2 ® H 2 + H 2 O.Безбарвний молибдат-іон MoO 4 2 окислюється Н 2 О 2 в інтенсивно забарвлений в помаранчевий колір ПЕРОКСИДНОГО аніон. Підкислений розчин дихромата калію в присутності Н 2 Про 2 утворює надхромовую кислоту: K2 Cr 2 O 7 + H 2 SO 4 + 5H 2 O 2® H 2 Cr 2 O 12 + K 2 SO 4 + 5H 2O, яка досить швидко розкладається: H 2 Cr 2 O 12 + 3H 2 SO 4 ® Cr 2 (SO 4) 3 + 4H 2 O + 4O 2. Якщо скласти ці два рівняння, вийде реакція відновлення пероксидом водню дихромата калію:K 2 Cr 2 O 7 + 4H 2 SO 4 + 5H 2 O 2® Cr 2 (SO 4) 3 + K 2 SO 4 + 9H 2 O + 4O 2.Надхромовую кислоту можна отримати з водного розчину ефіром (в розчині ефіру вона значно більш стійка, ніж у воді). Ефірний шар при цьому забарвлюється в інтенсивний синій колір.Ілля Леенсон
ЛІТЕРАТУРА Долгоплоск Б.А., Тинякова Є.І. Генерування вільних радикалів і їх реакції. М., Хімія, 1982Хімія і технологія перекису водню. Л., Хімія, 1984
Пероксид (перекис) водню являє собою безбарвну сиропообразную рідина щільністю, затвердевающую при -. Це дуже нетривке речовина, здатне розкладатися з вибухом на воду і кисень, причому виділяється велика кількість теплоти:
Водні розчини пероксиду водню більш стійкі; в прохолодному місці вони можуть зберігатися досить довго. Пергідроль - розчин, який надходить у продаж, - містить. У ньому, а також в висококонцентрованих розчинах пероксиду водню містяться стабілізуючі добавки.
Розкладання пероксиду водню прискорюється каталізаторами. Якщо, наприклад, в розчин пероксиду водню кинути трохи діоксиду марганцю, то відбувається бурхлива реакція і виділяється кисень. До стимуляторів, що сприяє розкладанню пероксиду водню, належать мідь, залізо, марганець, а також іони цих металів. Уже сліди цих металів можуть викликати розпад.
Пероксид водню утворюється як проміжний продукт при горінні водню, але з огляду на високої температуриводневого полум'я відразу ж розкладається на воду і кисень.

Мал. 108. Схема будови молекули. Кут близький до, кут - к. Довжини зв'язків:.
Однак якщо направити водневе полум'я на шматок льоду, то в утворюється воді можна виявити сліди пероксиду водню.
Пероксид водню виходить також при дії атомарного водню на кисень.
У промисловості пероксид водню отримують в основному електрохімічними методами, наприклад анодним окисленням розчинів сірчаної кислоти або гідросульфату амонію з подальшим гідролізом утворюється при цьому пероксодвусерной кислоти (див. § 132). Відбуваються при цьому процеси можна зобразити схемою:
![]()
У пероксиду водню атоми водню ковалентно пов'язані з атомами кисню, між якими також здійснюється проста зв'язок. Будова пероксиду водню можна виразити наступною структурною формулою: Н-О-О-Н.
Молекули мають значну полярністю, що є наслідком їх просторової структури (рис. 106).
У молекулі пероксиду водню зв'язку між атомами водню і кисню полярні (внаслідок зсуву загальних електронів в сторону кисню). Тому в водному розчині під впливом полярних молекул води пероксид водню може отщеплять іони водню, т. Е. Він володіє кислотними властивостями. Пероксид водню - дуже слабка двухосновная кислота у водному розчині він розпадається, хоча і в незначній мірі, на іони:
Дисоціація по другого ступеня
практично не протікає. Вона пригнічується присутністю води - речовини, дисоціюють з утворенням іонів водню в більшій мірі, ніж пероксид водню. Однак при зв'язуванні іонів водню (наприклад, при введенні в розчин лугу) дисоціація по другого ступеня відбувається.
З деякими підставами пероксид водню реагує безпосередньо, утворюючи солі.
Так, при дії пероксиду водню на водний розчин гідроксиду барію випадає осад бариевой солі пероксиду водню:
Солі пероксиду водню називаються пероксидамі або перекису. Вони складаються з позитивно заряджених іонів металу і негативно заряджених іонів, електронна будоваяких можна зобразити схемою:
![]()
Ступінь окислення кисню в пероксид водню дорівнює -1, т. Е. Має проміжне значення між ступенем окислення кисню в воді і в молекулярному кисні (0). Тому пероксид водню має властивості як окислювача, так і відновника, т. Е. Проявляє окисно-відновну двоїстість. Все ж для нього більш характерні окислювальні властивості, так як стандартний потенціал електрохімічної системи
в якій виступає як окислювач, дорівнює 1,776 В, в той час як стандартний потенціал електрохімічної системи
в якій пероксид водню є відновником, дорівнює 0,682 В. Інакше кажучи, пероксид водню може окисляти речовини, яких не перевищує 1,776 В, а відновлювати тільки ті, яких більше 0,682 В. За табл. 18 (на стор. 277) можна бачити, що в першу групу входить набагато більше речовин.
Як приклади реакцій, в яких служить окислювачем, можна привести окислення нітриту калію
і виділення йоду з йодиду калію:
Його використовують для відбілювання тканин і хутра, застосовують в медицині (3% розчин - дезінфікуючий засіб), в харчовій промисловості (при консервуванні харчових продуктів), в сільському господарстві для протруювання насіння, а також у виробництві ряду органічних сполук, полімерів, пористих матеріалів. Як сильний окислювач пероксид водню використовується в ракетній техніці.
Пероксид водню застосовують також для поновлення старих картин, написаних олійними фарбами і потемнілих від часу внаслідок перетворення свинцевих білил в чорний сульфід свинцю під дією містяться в повітрі слідів сірководню. При промиванні таких картин пероксидом водню сульфід свинцю окислюється в білий сульфат свинцю:

Крім води, відомо іншу сполуку водню з киснем - пероксид водню (Н 2 О 2). У природі він утворюється як побічний продукт при окисленні багатьох речовин киснем повітря. Сліди його постійно містяться в атмосферних опадах. Пероксид водню частково утворюється також в полум'я палаючого водню, але при охолодженні продуктів згоряння розкладається.
У досить великих концентраціях (до кількох відсотках) Н 2 О 2 може бути отримана взаємодією водню в момент виділення з молекулярним киснем. Пероксид водню частково утворюється також при нагріванні до 2000 ° С вологого кисню, при проходженні тихого електричного розряду крізь вологу суміш водню з киснем і при дії на воду ультрафіолетових променів або озону.
Теплота утворення пероксиду водню.
Безпосередньо визначити теплоту освіти пероксиду водню з елементів не вдається. Можливість знайти її непрямим шляхом дає встановлений Г. І. Гессом (1840 г.) закон сталості сум тепла: загальний тепловий ефект ряду послідовних хімічних реакцій дорівнює тепловому ефекту будь-якого іншого ряду реакцій з тими ж самими вихідними речовинами і кінцевими продуктами.
Строго кажучи, закон Гесса слід було б сформулювати, як "закон сталості сум енергій", тому що при хімічних перетвореннях енергія може виділятися або поглинатися не тільки в тепловій, але і як механічна, електрична та ін. Крім того, передбачається, що розглядаються процеси протікають при постійному тиску або постійному об'ємі. Як правило, саме так і йде справа при хімічних реакціях, а всі інші форми енергії можуть бути перераховані на теплову. Сутність цього закону особливо наочно виявляється в світлі наступної механічної аналогії: загальна робота, вироблена опускається без тертя вантажем, залежить не від шляху, а тільки від різниці початковою і кінцевою висот. Подібним же чином загальний тепловий ефект тієї чи іншої хімічної реакціївизначається тільки різницею теплот освіти (з елементів) її кінцевих продуктів і вихідних речовин. Якщо всі ці величини відомі, то для обчислення теплового ефекту реакції досить із суми теплот освіти кінцевих продуктів відняти суму теплот утворення вихідних речовин. Законом Гесса часто користуються при обчисленні теплот таких реакцій, для яких пряме експериментальне їх визначення важко або навіть неможливо.
У застосуванні до Н 2 О 2 розрахунок можна провести на основі розгляду двох різних шляхів утворення води:
1. Нехай спочатку при з'єднанні водню і кисню утворюється пероксид водню, який потім розкладається на воду і кисень. Тоді матимемо такі два процеси:
2 Н 2 + 2 О 2 = 2 Н 2 О 2 + 2х кДж
2 Н 2 О 2 = 2 Н 2 О + О 2 + 196 кДж
Тепловий ефект останньої реакції легко визначається експериментально. Складаючи почленно обидва рівняння і скорочуючи поодинокі члени, отримуємо
2 Н 2 + О 2 = 2 Н 2 О + (2х + 196) кДж.
2. Нехай при з'єднанні водню з киснем безпосередньо утворюється вода, тоді маємо
2 Н 2 + О 2 = 2 Н 2 О + 573 кДж.
Так як в обох випадках і вихідні речовини, і кінцеві продукти однакові, 2х + 196 = 573, звідки х = 188,5 кДж. Це і буде теплота освіти благаючи пероксиду водню з елементів.
Отримання.
Пероксид водню найпростіше отримувати з пероксиду барію (ВАО2), діючи на неї розведеної сірчаною кислотою:
ВаО 2 + Н 2 SO 4 = BaSO 4 + Н 2 О 2.
При цьому поряд з пероксидом водню утворюється нерозчинний у воді сульфат барію, від якого рідина може бути відділена фільтруванням. Продається Н2О2 зазвичай у вигляді 3% -ного водного розчину.
Тривалим упариванием звичайного 3% -ного водного розчину Н 2 О 2 при 60-70 ° С можна довести вміст у ньому пероксиду водню до 30%. Для отримання більш міцних розчинів отгонку води доводиться проводити під зменшеним тиском. Так, при 15 мм рт. ст. спочатку (приблизно з 30 ° С) відганяється головним чином вода, а коли температура досягає 50 ° С, в перегінній колбі залишається дуже концентрований розчин пероксиду водню, з якого при сильному охолодженні можуть бути виділені його білі кристали.
Основним методом одержання пероксиду водню є взаємодія з водою надсірчані кислоти (або деяких її солей), легко протікає за схемою:
Н 2 S 2 O 8 + 2 H 2 O = 2 H 2 SO 4 + Н 2 О 2.
Менше значення мають деякі нові методи (розкладання органічних пероксидних сполук та ін.) І старий спосіб отримання з ВаО 2. Для зберігання і перевезення великих кількостей пероксиду водню найбільш придатні ємності з алюмінію (не нижче 99,6% -ної чистоти).
Фізичні властивості.
Чистий пероксид водню - безбарвна сиропообразная рідина (з щільністю близько 1,5 г / мл), під досить зменшеним тиском переганяє без розкладання. Замерзання Н 2 О 2 супроводжується стисненням (на відміну від води). Білі кристали пероксиду водню плавляться при -0,5 ° С, т. Е. Майже при тій же температурі, що і лід.
Теплота плавлення пероксиду водню становить 13 кДж / моль, теплота випаровування - 50 кДж / моль (при 25 ° С). Під звичайним тиском чистий Н 2 О 2 кипить при 152 ° С з сильним розкладанням (причому пари можуть бути вибухонебезпечні). Для його критичних температури і тиску теоретично розраховані значення 458 ° С і 214 атм. Щільність чистого Н 2 О 2 дорівнює 1,71 г / см3 в твердому стані, 1,47 г / см3 при 0 ° С і 1,44 г / см3 при 25 ° С. Рідкий пероксид водню, як і вода, сильно асоційована. Показник заломлення Н 2 О 2 (1,41), а також її в'язкість і поверхневий натяг трохи вище, ніж у води (при тій же температурі).
Структурна формула.
Структурна формула пероксиду водню Н-О-О-Н показує, що два атоми кисню безпосередньо з'єднані один з одним. Зв'язок це міцна і обумовлює нестійкість молекули. Дійсно, чиста Н 2 О 2 здатна розкладатися на воду і кисень з вибухом. У розбавлених водних розчинах вона значно стійкіше.
Оптичними методами встановлено, що молекула Н-О-О-Н не лінійна: зв'язки Н-О утворюють кути близько 95 ° зі зв'язком О-О. Крайніми просторовими формами молекул подібного типу є показані нижче плоскі структури - цис-форма (обидві зв'язку Н-О по одну сторону від зв'язку О-О) і транс-форма (зв'язку Н-О по різні боки).
Перехід від однієї з них до іншої міг би здійснюватися шляхом повороту зв'язку Н-О по осі зв'язку О-О, але цьому перешкоджає потенційний бар'єр внутрішнього обертання, обумовлений необхідністю проміжного подолання менш енергетично вигідних станів (на 3,8 кДж / моль для транс- форми і на 15 кДж / моль для цис-форми). Практично кругове обертання зв'язків Н-Ов молекулах Н 2 О 2 не здійснюється, а відбувається лише деякі їх коливання близько найбільш стійкого для даної молекули проміжного стану - косою ( "гош") - форми.
Хімічні властивості.
Чим чистіше пероксид водню, тим повільніше вона розкладається при зберіганні. Особливо активними каталізаторами розкладання Н 2 О 2 є з'єднання деяких металів (Сu, Fe, Mn і ін.), Причому помітно діють навіть такі їх сліди, які не піддаються прямому аналітичному визначенню. Для зв'язування етил металів до пероксиду водню в якості "стабілізатора" часто додають трохи (близько 1:10 000) пірофосфату натрію - Na 4 P 2 O 7.
Сама по собі лужна середу не викликає розкладання пероксиду водню, але сильно сприяє її каталітичного розпаду. Навпаки, кислотна середу цей розпад ускладнює. Тому розчин Н 2 О 2 часто підкисляють сірчаною або фосфорною кислотою. Розкладання пероксиду водню йде швидше при нагріванні і на світлі, тому зберігати його слід в темному прохолодному місці.
Подібно воді, пероксид водню добре розчиняє багато солі. З водою (також зі спиртом) вона змішується в будь-яких співвідношеннях. Розведений його розчин має неприємний "металевий" смак. При дії на шкіру міцних розчинів виходять опіки, причому обпечене місце забарвлюється в білий колір.
Нижче сопоставлена розчинність деяких солей у воді і пероксид водню при 0 ° С (г на 100 г розчинника):